АТФ (аденозинтрифосфат): молекула, обеспечивающая энергией живые клетки
Рис. 10.1. Строение аденозинтрифосфата (АТФ)
Утечка электронов приводит к образованию активных форм кислорода
Примерно 2% электронов высвобождаются из дыхательной цепи и связываются непосредственно с кислородом, образуя активные формы кислорода (АФК). Если работа дыхательной цепи нарушена, АФК образуются в большем количестве. Эти вещества повреждают митохондрии, вызывая все большие нарушения дыхательной цепи. Возникает порочный круг, и в результате из-за накопления различных повреждений под действием АФК происходит старение клетки.
Дыхательные яды
Вещества, которые ингибируют образование АТФ, потенциально токсичны для организма.
Амитал и ротенон блокируют транспорт электронов в комплексе I. Ротенон выделяют из корней растения деррис (Derris scandens) и нередко используют в качестве природного пестицида. Он малотоксичен для человека, поскольку плохо всасывается в желудочно-кишечном тракте. Однако ротенон ядовит для рыб, так как быстро всасывается через жабры. К тому же при долговременном воздействии ротенон опасен и для человека, так как вызывает развитие .
Антимицин блокирует транспорт электронов в комплексе III.
Цианиды(CN-) , угарный газ (СО) и азиды (N3-) ингибируют комплекс IV. Поэтому при отравлении цианидом блокируются аэробные метаболические процессы, несмотря на то что кровь достаточно насыщена кислородом. Из-за остановки аэробного метаболизма венозная кровь принимает цвет артериальной крови. Кроме того, наблюдается гипервентиляция, поскольку из-за накопления молочной кислоты стимулируется дыхательный центр.
Олигомицин блокирует протонный канал (F0 в комплексе V) и не дает протонам возвращаться в матрикс. Поэтому АТФ-синтаза (F1) теряет способность синтезировать АТФ.
Биосинтез АТФ путем окислительного фосфорилирования (часть II)

На рис. 13.1 показан поток электронов и протонов в дыхательной цепи. Электроны и протоны от НАДН+ через комплекс I и от ФАДН2 через комплекс II передаются комплексу III . Затем электроны транспортируются в комплекс IV , где они присоединяются к кислороду. В это время протоны выкачиваются протонными насосами из матрикса в межмембранное пространство и возвращаются обратно в матрикс через протонный канал F0-субъединицы АТФ-синтазы (комплекс V ). Поток протонов (протонный ток) включает молекулярным двигатель - F1-субъединицу АТФ-синтазного комплекса , и она располагает молекулы АДФ и Фн таким образом, что они объединяются в молекулы АТФ .
3.Коэффициент окислительного фосфорилирования
Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТФ; электроны от FAD-зависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ. Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Следовательно, для NADH Р/О = 3, для сукцината Р/О - 2. Эти величины отражают теоретический максимум синтеза АТФ, фактически эта величина меньше.
49.Регуляция цепи переноса электронов (дыхательный контроль). Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания. Термогенная функция энергетического обмена в бурой жировой ткани.
4.Дыхательный контроль
Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз.
Б. Транспорт АТФ и АДФ через мембраны митохондрий
В большинстве эукариотических клеток синтез основного количества АТФ происходит внутри митохондрии, а основные потребители АТФ расположены вне её. С другой стороны, в матриксе митохондрий должна поддерживаться достаточная концентрация АДФ. Эти заряженные молекулы не могут самостоятельно пройти через липидный слой мембран. Внутренняя мембрана непроницаема для заряженных и гидрофильных веществ, но в ней содержится определённое количество транспортёров, избирательно переносящих подобные молекулы из цитозоля в матрикс и из матрикса в цитозоль.
В мембране есть белок АТФ/АДФ-антипортер, осуществляющий перенос этих метаболитов через мембрану (рис. 6-16). Молекула АДФ поступает в митоходриальный матрикс только при условии выхода молекулы АТФ из матрикса.
Движущая сила такого обмена - мембранный потенциал переноса электронов по ЦПЭ. Расчёты показывают, что на транспорт АТФ и АДФ расходуется около четверти свободной энергии протонного потенциала. Другие транспортёры тоже могут использовать энергию электрохимического градиента. Так переносится внутрь митохондрии неорганический фосфат, необходимый для синтеза АТФ. Непосредственным источником свободной энергии для транспорта Са 2+ в матрикс также служит протонный потенциал, а не энергия АТФ.
В. Разобщение дыхания и фосфорилирования
Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH 2 возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители - липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ - 2,4-динитрофенол, легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс.
Примерами разобщителей могут быть также некоторые лекарства, например дикумарол - антикоагулянт или метаболиты, которые образуются в организме, билирубин - продукт катаболизма тема, тироксин - гормон щитовидной железы. Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
Г. Терморегуляторная функция ЦПЭ
На синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела. Кроме того, дополнительное образование теплоты может происходить при разобщении дыхания и фосфорилирования. Разобщение окислительного фосфорилирования может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождённых, у зимнеспящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождённых, а также зимнеспящих животных существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования - бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) - термогенин. Бурый жир имеется у новорождённых, но его практически нет у взрослого человека. В последние годы появились факты, свидетельствующие о существовании в митохондриях разных органов и тканей млекопитающих разобщающих белков, похожих по своей структуре на РБ-1 бурой жировой ткани. По своей структуре термогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями.
На внешней стороне мембраны анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембраны диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующийся анион возвращается на наружную сторону мембраны с помощью АТФ/ АДФ-антипортера.
При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой ткани и мобилизация жира из жировых депо. Образующиеся свободные жирные кислоты служат не только "топливом", но и важнейшим регулятором разобщения дыхания и фосфорилирования.
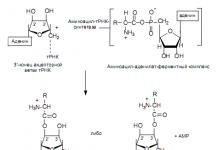
Как известно, живые системы функционируют благодаря использованию различных видов энергии трансформированием их в энергию химических связей. В клетке химическая энергия запасается в виде так называемых «высокоэнергетических» метаболитов. Наиболее важным таким метаболитом, макроэргом, обеспечивающим энергией большинство энергозависимых процессов в клетке, является нуклеотидный коэфермент аденозинтрифосфат АТФ (рис.1). В молекуле АТФ цепочка из трех фосфатных остатков (α, β, γ) связана 5 ΄ -ОН-группой аденозин. Рибоза связана с α-фосфатом устойчивой фосфорноэфирной связью. Три фососфатных остатка связаны между собой менее устойчивыми фосфоангидридными связями. При физиологических значениях рН АТФ несет четыре отрицательных заряда. Изменение свободной энергии ΔG 0 гидролиза фосфоангидридных связей составляет 30-35 кДж/моль. В клетке, в физиологических условиях измение свободной энергии гидролиза АТФ еще выше и может доходить до 50 кДж/моль. Гидролиз АТФ в клетках сопровождается выделением свободной энергии, которая расходуется на выполнение эндергонических (энергозатратных) процессов, таких как биосинтез, движение, транспорт и др. Соответственно, синтез АТФ является высоко эндергонической реакцией, поэтому он должен сопрягаться высоко экзергоническим процессом. Молекула АТФ является самым важным и универсальным энергетическим посредником, которая обеспечивает генерирование химической энергии и ее использование для выполнения биологических функций у всех организмов. Остальные нуклеозидтрифосфатные коэферменты, химически похожие на АТФ (ГТФ, ЦТФ, УТФ) выполняют в метаболических процессах другие функции.
Рис.1. Структура молекулы АТФ (кольман,125)
В ходе эволюции сформировались два важных способа синтеза АТФ, которые реализуются в живых клетках. Наиболее эффективный способ синтеза АТФ – это использование энергии градиента электрохимического потенциала биологических мембран для образования АТФ из АДФ и неорганического фосфата. Энергия для создания такого градиента возникает в результате окислительно-восстановительного процесса в результате окисления химических субстратов (окислительное фосфорилирование) или под действием световой энергии (фотофосфорилирование).
Второй, эволюционно более ранний способ синтеза АТФ осуществляется в анаэробных условиях. В этом случае перенос фосфатной группы на АТФ осуществляется через метаболит с высоким потенциалом переноса фосфатных групп. В качестве примера можно привести реакцию синтеза АТФ из креатинфосфата в мышечных клетках.
По способу преобразования энергии организмы (клетки) подразделяются на большие 2 группы : автотрофы и гетеротрофы. Автотрофы для синтеза АТФ используют энергию электромагнитных (световых) волн или. Гетеротрофы – для синтеза АТФ используют энергию химических связей органических субстратов.
Синтез АТФ у автотрофных организмов мы подробно будем говорить на лекции, посвященному фотосинтезу. Сейчас приступим к рассмотрению процесса синтеза АТФ у аэробных организмов - окислительного фосфорилирования. Впервые синтез АТФ, сопряженный с внутриклеточным дыханием был обнаружен в начале 30-ых годов 20 века российским биохимиком В. А. Энгельгардом. Другой россиянин, В.А. Белицер, в 1939 году предположил, что окислительное фосфорилирование АДФ сопряжено с переносом электронов в дыхательной цепи. Американские ученые А.Ленинджер и Е. Кеннеди в 1949 году показали, что процесс окислительного фосфорилирования протекает в митохондриях.
Из курса цитологии вам известно, что митохондрии – это органеллы клетки палочкообразной или округлой формы, сравнительно больших размеров (до 2-3 мкм). Митохондрия окружена двойной элементарной мембраной, толщина каждой мембраны около 7-8 нм. Митохондрия имеет два внутренних отсека (компартмента): пространство между внутренней и внешней мембраной (межмембранное пространство ) и матрикс , пространство, ограниченное внутренней мембраной. Внутренняя мембрана образует многочисленные складки и выступы (кристы ), за счет чего достигается увеличение поверхности внутренней мембраны (рис.2). В митохондриях за счет окислительной деградации питательных веществ синтезируется большая часть необходимого клетке АТФ.
 |
| Рис. 2. Схема общей организации митохондрии 1 - внешняя мембрана; 2 - внутренняя мембрана; 3 - впячивания внутренней мембраны - кристы; 4 - места впячиваний, вид с поверхности внутренней мембраны |
Главной функцией митохондрий является захват богатых энергией субстратов (жирные кислоты, пируват, углеродный скелет аминокислот) из цитоплазмы и их окислительное расщепление до СО 2 и Н 2 О, сопряженнное с синтезом АТФ. Соответственно, в митохондриях локализованы следующие метаболические процессы: 1) превращение топливных субстратов в ацетил-КоА 2) восстановление НАДН и ФАДН 2 в цикле Кребса 4) синтез АТФ в дыхательной цепи (рис. 3). Реакции двух первых процессов локализованы в матриксе, а дыхательная цепь располагается на внутренней мембране митохондрий. На этой мембране митохондрии находятся молекулярные переносчики электронов и ферменты, составляющие дыхательную (электронно-транспортную ) цепь. Компоненты дыхательной цепи осуществляют перенос электронов от НАДН или восстановленной формы убихинона QН 2 на молекулярный кислород. Вследствие большой разницы окислительно-восстановительных потенциалов (ОВП) доноров (НАДН 2 и QН 2) и акцептора (О 2), реакция переноса электронов является высоко экзергонической. Большая часть освобождающейся энергии расходуется на создание градиента концентрации протонов, которую фермент АТФ-синтаза использует для образования молекулы АТФ.
Основные компоненты ЭТС митохондрий следующие: комплекс 1 (НАДН: убихинон –оксиредуктаза или НАДН-дегидрогеназа); комлекс 11 (сукцинат: убихинон-оксиредуктаза или сукцинатдегидрогеназа); комплекс 111 (убихинол: цитохром с – оксиредуктаза); комплекс 1У (цитохром с: кислородоксиредуктаза); цитохром с; АТФ- синтетаза; АДФ – АТФ – транслоказа; убихинон..
Перечисленные компоненты ЭТС на мембране митохондрий располагаются в следующих стехиометрических соотношениях: комплекс 1: комплекс 2: комплекс 3: комплекс 4 как 1: 2: 3: 6. На каждый комплекс 1У приходится по 1 молекуле АТФ-азы и по 3-5 молекул АДФ-АТФ – транслоказы.
Перенос электронов по дыхательной цепи. Электроны, окисляющие кислород, проходят, по меньшей мере, десять промежуточных окислительно-восстановительных систем, большинство из которых представлены простетическими группами в комплексах 1, 111, 1У. Молекулярные переносчики (НАДН, флавопротеины, содержащие ФАД и ФМН в качестве простетических групп, убихинон) акцептируют и отдают по 2 электрона. Негемовые железосерные белки и цитохромы, содержащие порфириновые простетические группы, переносят по одному электрону (рис. 3).

Рис.3 . Поток электронов через три главных ферментативных комплекса при переносе электронов от НАД·Н к О 2
1 - НАД·Н-дегидрогеназный комплекс; 2 - с 1 -комплекс; 3 - цитохромоксидазный комплекс; 4 - убихинон; 5 - цитохром с; 6 - матрикс митохондрии; 7 - внутренняя митохондриальная мембрана; 8 - межмембранное пространство
Комплекс 1 катализирует перенос двух электронов от НАДН к убихинону и он также способен транспортировать через мембрану протоны. Комплекс 1 содержит ФМН и несколько белков с железносерными центрами с типом кластера 2 Fe – 2S и 4 Fe – 4S (рис.4). Согласно современным представлениям, эти центры представляют собой многоядерные комплексы железа, ковалентно связанные с атомами серы и цистеиновыми остатками белков.
Рис.4. Схема расположения железосерных кластеров в белковых молекулах. (Костюк, 321)
Комплекс 11 катализирует окисление сукцината убихиноном и не может переносить протоны. Комплекс содержит ФАД, цитохром b 557 и два железосерных центра Fe – S с типом кластера 2 Fe – 2S и один железносерный центр с типом кластера 4 Fe – 4S. Убихинон (коэнзим Q) в митохондриях животных клеток представлен в форме Q 10 , т.е. его молекула содержит цепь из 10 пятиуглеродных изопреновых остатков, что определяет высокую гидрофобность этой молекулы. Убихинон хорошо растворяется в липидной фазе мембраны и способен к трансмембранному переходу путем диффузии. Присоединяя два электрона и два протона, убихинон восстанавливается и превращается в убихинол QН 2 .
Комплекс 111 катализирует перенос электронов от убихинола к цитохрому с, способен также транспортировать протоны. В состав этого комплекса входят цитохромы b 562 , b 566 , цитохром c 1 , железносерный центр с типом кластеров 2 Fe – 2S.
Комплекс 1У переносит электроны от цитохрома с к кислороду. В состав этого комплекса входят фермент цитохром с-оксидаза с двумя гемами в молекулах цитохромов а и а 3 и два атома меди. Окисленная форма (Fe 3+) цитохромов а и а 3 принимает электроны от восстановленного цитохрома с и переходит в восстановленную форму (Fe 2+).
Значительная часть свободной энергии, которая выделяется при переносе электронов по ЭТС, запасается в форме АТФ на участках сопряжения биологического окисления с фосфорилированием. Участки сопряжения локализованы: 1) между НАДН-дегидрогеназой и цитохромом b, 2) между цитохромом b и цитохромом с, 3) между цитохромом с и кислородсвязывающим участком комплекса 1У (см. рис. 3). На этих участках ЭТС количество выделяющейся энергии достаточно для образования фосфоангидридной связи.
По-существу, транспорт электронов по дыхательной цепи митохондрии представляет собой последовательнось окислительно-восстановительных реакций. Перенос электронов в ЭТС осуществляется по градиенту значений окислительно-восстановительных потенциалов (ОВП) пар: донор электронов-акцептор электронов. Как известно, значение ОВП выражается в вольтах и характеризует способность донора отдавать электрон(ы) акцептору в сопряженной окислительно-восстановительной паре. ОВП окислительно-восстановительной пары может иметь и положительное, и отрицательное значение. Чем выше абсолютное значение ОВП системы, тем выше окислительно-восстановительные свойства системы. Величина и знак ОВП для окислительно- восстановительных пар позволяет предсказать направление движения электронов: электроны транспортируются от отрицательно заряженного донора к положительно заряженному (по отношению к донору) акцептору. Определение ОВП окислительно-восстановительных пар проводят путем измерения электродвижучей силы (ЭДС) с использованием стандартного (водородного) электрода. Водородный электрод представляет собой платиновую пластину, который погружен в 1 М раствор Н + находящийся в равновесии с газообразным Н 2 при давлении 1 атм. Потенциал такого стандартного электрода условно принимают равным нулю. Стандартный окислительно восстановительный потенциал Е 0 характеризует способность исследуемой редокс-системы окислять или восстановливать водородный электрод, при однаковой концентрации окислителя и восстановителя. Величину ОВП можно найти по следующей формуле
Е 0 = Е 0 + RTln Ox/ Red/nF
где Е 0 – стандартный редокс-потенциал; R – универсальная газовая постоянная; Т- абсолютная температура; Ox/ Red –отношение концентрации окисленной и восстановленной форм вещества; F- число Фарадея; n –число переносимых электронов.
В электронно-транспортной цепи митохондрий восстановителем (донором электронов) является атом водорода (в составе НАДН и ФАДН 2), окислителем служит атом кислорода, который в процессе дыхания восстановливается до Н 2 О. Как отмечалось выше, между этими молекулами находятся не менее 10 промежуточных молекулярных переносчиков электронов, за счет работы которых энергия окислительно-восстановительных реакций преобразуется в энергию фосфоангидридной связи в молекуле АТФ. Энергия образования фосфоангидридной связи в АТФ при стандартных условиях составляет ΔG 0 = - 35 кДж/моль, что соответствует изменению редокс-потенциала Δ Е 0 = - ΔG 0 / nF = 0,18 В. Величина окислительно–восстановительного потенциала ЭТС митохондрий составляет 1,14 В, что эквивалентно 220 Кдж. В таблице 1 приведены Значения ОВП окислительно-восстановительных пар (основных молекулярных переносчиков), локализованных в дыхательной цепи.
Таблица 1.
Значения окислительно-восстановительных потенциалов молекулярных переносчиков электронов в дыхательной цепи митохондрий
Синтез АТФ на мембранах митохондрий . Фосфорилирование АДФ осуществляется встроенным в внутренную мембрану митохондрий ферментом - Н + -зависимой АТФ-синтазой. По современным представлениям, мембранная АТФ-синтаза является миниатюрным молекулярным мотором. Принцип его работы подобен работе электродвигателя, т.е. вращение ротора происходит вследствие прохождения электрического тока через его обмотку. В отличие от искусственных электромоторов, в АТФ-синтазе вращение ротора осуществляется не потоком электронов, а потоком протонов. До недавнего времени считалось, что самыми миниатюрными «живыми» моторами являются флагеллярные моторы, которые генерируют движение бактерий. Однако, оказалось, что самым маленьким из всех известных в природе вращающихся моторов является протонная АТФ-синтаза. Такие молекулы обнаружены в митохондриях, хлоропластах, на плазматических мембранах бактерий. Исследования последних лет показали, что АТФ-азы в энергопреобразующих мембранах клеток растений, животных и бактерий по струтуре и функциям не имеют существенных различий.
На рис. 4 показана структура ферментного комплекса, полученная на основе данных рентгеноструктурного анализа АТФ-азы из митохондрий сердца быка. Как видно, молекула этой АТФ-азы состоит из двух функциональных частей: встроенного в мембрану протонного канала F 0 и каталитической части F 1 , выступающей в матрикс митохондрии. Этот ансамбль имеет вид слегка приплюснутого шара высотой 8 нм и шириной 10 нм. В центре шара находится субъединица g, которая образована двумя протяженными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. Нижняя часть субъединицы g выступает из шара на 3 нм в сторону мембранного комплекса F 0 . Субъединица d расположена на внешней стороне F 1 . Внутри ансамбля (ab) 3 находится минорная субъединица e , которая связана с субъединицей g. Обе эти субъединицы (g и e) подвижны - они входят в состав своеобразного ротора, который вращается внутри неподвижного комплекса (ab) 3 .
Мембранный комплекс F 0 служит основанием, которое удерживает АТФ-синтазу в мембране.Этот комплекс включает в себя протонный канал, по которому ионы водорода переносятся через АТРсинтазу Пространственная структура F 0 расшифрована не столь детально, как строение водорастворимого комплекса f 1. Ориентированный в водную фазу (в матрикс митохондрии) комплекс F 1 состоит из девяти субъединиц пяти типов полипептидов (Зa, Зb, g, d, e). Полипептидные цепи субъединиц a и b уложены в похожие по строению белковые глобулы, которые все вместе образуют гексамер -ансамбль, состоящий из шести субъединиц.

Рис. 4. Схематичное изображение АТФ-синтазы в мембранах митохондрий
А. Схема расположения основных белковых субьединиц, образующих комплексы F 0 и F 1
Б. АТФ-синтаза - внутриклеточный электродвигатель: Ротор – g, e - субьединицы (обозначены красным цветом); статор - Зa, Зb, d, c, a, b - субьединицы (обозначены синим цветом).
Представления об АТФ-синтазе, как молекулярной машине, работа которой связана с ее вращением, хорошо согласуются со структурными особенностями комплекса. В структуре АТФ-синтазы можно выделить две группы белковых субъединиц: одна из них образует статор мотора, который неподвижен относительно мембраны, а другая соответствует подвижному ротору, вращающемуся внутри статора. Статор включает в себя шарообразный гексамер, состоящий из трех субъединиц a и трех субъединиц b, находящуюся на его поверхности субъединицу d, а также субъединицы a и b мембранного комплекса F 0 (рис 4,Б). В этой макромолекулярной конструкции субъединицы b выполняют роль своеобразного кронштейна, связывающего неподвижные субъединицы комплексов F 0 и F 1 . К находящейся в мембране субъединице а примыкает гидрофобное кольцо, образованное субъединицами с мембранного комплекса F 0 .
Ротор состоит из субъединиц g и e комплекса F 1 . Субъединица g, расположенная внутри комплекса (ab) 3 , заметно выступает из него и соединяется с погруженным в мембрану кольцом из субъединиц с . Имеются все основания считать, что субъединица g, входящая в состав ротора, действительно вращается при работе фермента. Для того, чтобы провернуть ротор внутри статора, и тем самым заставить АТФ- синтазу сделать молекулу АТР, необходим внешний источник энергии. Как уже было сказано выше, когда АТФ-синтаза работает в режиме синтеза АТФ, движущей силой для ее работы является энергия протонов, переносимых через сопрягающую мембрану за счет протонного потенциала. При работе АТФ-синтазы в режиме гидролиза АТФ источником энергии для вращения ротора служит энергия, запасенная в молекуле АТФ.
Наглядно показано, что гидролиз АТР комплексом F 1 , действительно сопровождается вращением субъединицы g относительно гексамера (ab) 3 . Об этом свидетельствуют работы американцев Капальди, Кросса и их сотрудников. Им удалось пришить субъединицу g к субъединице b и тем самым блокировать возможное вращение субъединицы g внутри комплекса F 1 . В этом случае, ферментативная активность комплекса F 1 , (его способность гидролизовать АТФ) при этом была полностью подавлена.
Самым впечатляющим доказательством того, что субъединица γ, действительно крутится в ходе работы фермента, стала замечательная работа, группой японских исследователей Киношите, Йошиде и их соавторами. Они увидели вращение субъединицы γ, с помощью флуоресцентного микроскопа. Как можно разглядеть вращение ротора, диаметр которого составляет всего лишь 1 нм? Чтобы наблюдать за вращением этой субъединицы, к ее основанию, выступающему из комплекса F 1 , японские ученые прикрепили специальный макромолекулярный маркер - фрагмент нити актина длиной около одного микрона, который, в свою очередь, был помечен флуоресцентным красителем. Остальную часть отделенной от мембраны молекулы f 1 обездвижили, пришив к субъединицам b специальные хвостики, с помощью которых F 1 прикрепили к неподвижной подложке. Наблюдая с помощью микроскопа за изменением положения флуоресцирующей нити актина, жестко связанной субъединицей γ, удалось непосредственно увидеть ее вращение. Оказалось, что в ходе работы фермента, гидролизующего АТФ, актиновый хвост вращается против часовой стрелки. Эти эксперименты продемонстрировали, в буквальном смысле этого слова, вращение самого маленького из всех известных к настоящему времени природных моторов. Вместе с этим в науке окончательно утвердилось новое понятие - вращательный катализ (англ. - rotary catalysis).
Замечательным качеством вращающегося мотора АТФ-синтазы является его исключительно высокий коэффициент полезного действия. Показано, что для поворота актинового хвоста на 120° затрачивается около 35 кДж энергии, т.е. приблизительно равная энергии образования АТФ из АДФ. Это означает, что КПД работы мотора близок к 100 %.
В табл. 2 приведены сравнительные характеристики различных молекулярных моторов, встречающихся в живой клетке. Видно, что АТФ-синтаза является своего рода рекордсменом среди молекулярных моторов своей "весовой категории". По эффективности работы и развиваемой ею силе она существенно превосходит все известные в природе молекулярные моторы. Так, например, максимальная сила, создаваемая при работе одного миозинового мостика актомиозинового комплекса мышечных волокон, составляет F макс = 3-5 пН. Вращательный момент, создаваемый молекулой f 1 за счет гидролиза АТФ, достигает величины М = 40 пН нм. Если учесть, что радиус вращающейся субъединицы составляет r = 1 нм, то сила F макс развиваемая молекулой f 1 , будет равна 40 пН. Оказывается, что молекула F 1 , приблизительно в 10 раз сильнее актомиозинового комплекса - молекулярной машины, специализирующейся в клетках и различных органах на "профессиональном" выполнении механической работы. Таким образом, за сотни миллионов лет до того, как появился человек, который изобрел колесо, преимущества вращательного характера движения были успешно реализованы природой на молекулярном уровне.
Аденозинтрифосфорная кислота-АТФ - обязательный энергетический компонент любой живой клетки. АТФ также нуклеотид, состоящий из азотистого основания аденина, сахара рибозы и трех остатков молекулы фосфорной кислоты. Это неустойчивая структура. В обменных процессах от нее последовательно отщепляются остатки фосфорной кислоты путем разрыва богатой энергией, но непрочной связи между вторым и третьим остатками фосфорной кислоты. Отрыв одной молекулы фосфорной кислоты сопровождается выделением около 40 кДж энергии. В этом случае АТФ переходит в аденозиндифосфорную кислоту (АДФ), а при дальнейшем отщеплении остатка фосфорной кислоты от АДФ образуется аденозинмонофосфорная кислота (АМФ).
Схема строения АТФ и превращения ее в АДФ (Т.А. Козлова, В.С. Кучменко. Биология в таблицах. М.,2000)
Следовательно, АТФ - своеобразный аккумулятор энергии в клетке, который "разряжается" при ее расщеплении. Распад АТФ происходит в процессе реакций синтеза белков, жиров, углеводов и любых других жизненных функций клеток. Эти реакции идут с поглощением энергии, которая извлекается в ходе расщепления веществ.
АТФ синтезируется в митохондриях в несколько этапов. Первый из них - подготовительный - протекает ступенчато, с вовлечением на каждой ступени специфических ферментов. При этом сложные органические соединения расщепляются до мономеров: белки - до аминокислот, углеводы - до глюкозы, нуклеиновые кислоты - до нуклеотидов и т. д. Разрыв связей в этих веществах сопровождается выделением небольшого количества энергии. Образовавшиеся мономеры под действием других ферментов могут претерпеть дальнейший распад с образованием более простых веществ вплоть до диоксида углерода и воды.
Схема Синтез АТФ в мвтохондрии клетки
ПОЯСНЕНИЯ К СХЕМЕ ПРЕВРАЩЕНИЕ ВЕЩЕСТВ И ЭНЕРГИИ В ПРОЦЕССЕ ДИССИМИЛЯЦИИ
I этап - подготовительный: сложные органические вещества под действием пищеварительных ферментов распадаются на простые, при этом выделяется только тепловая энергия.
Белки ->аминокислоты
Жиры->
глицерин и жирные кислоты
Крахмал ->глюкоза
II этап-гликолиз (бескислородный): осуществляется в гиалоплазме, с мембранами не связан; в нем участвуют ферменты; расщеплению подвергается глюкоза:
У дрожжевых грибов молекула глюкозы без участия кислорода превращается в этиловый спирт и диоксид углерода (спиртовое брожение):
У других микроорганизмов гликолиз может завершаться образованием ацетона, уксусной кислоты и т, д. Во всех случаях распад одной молекулы глюкозы сопровождается образованием двух молекул АТФ. В ходе бескислородного расщепления глюкозы в виде химической связи в молекуле АТФ сохраняется 40% анергии, а остальная рассеивается в виде теплоты.
III этап-гидролиз (кислородный): осуществляется в митохондриях, связан с матриксом митохондрий и внутренней мембраной, в нем участвуют ферменты, расщеплению подвергается молочная кислота: СзН6Оз+ЗН20 -->3СО2+ 12Н. С02 (диоксид углерода) выделяется из митохондрий в окружающую среду. Атом водорода включается в цепь реакций, конечный результат которых - синтез АТФ. Эти реакции идут в такой последовательности:
1. Атом водорода Н с помощью ферментов-переносчиков поступает во внутреннюю мембрану митохондрий, образующую кристы, где он окисляется: Н-е-->H+
2. Протон водорода H+
(катион) выносится переносчиками на наружную поверхность мембраны крист. Для протонов эта мембрана непроницаема, поэтому они накапливаются в межмембранном пространстве, образуя протонный резервуар.
3. Электроны водорода e переносятся на внутреннюю поверхность мембраны крист и тут же присоединяются к кислороду с помощью фермента оксидазы, образуя отрицательно заряженный активный кислород (анион): O2 + е-->O2-
4. Катионы и анионы по обе стороны мембраны создают разноименно заряженное электрическое поле, и когда разность потенциалов достигнет 200 мВ, начинает действовать протонный канал. Он возникает в молекулах ферментов АТФ-синтетаз, которые встроены во внутреннюю мембрану, образующую кристы.
5. Через протонный канал протоны водородаH+
устремляются внутрь митохондрий, создавая высокий уровень энергии, большая часть которой идет на синтез АТФ из АДФ и Ф (АДФ+Ф-->АТФ), а протоны H+
взаимодействуют с активным кислородом, образуя воду и молекулярный 02:
(4Н++202- -->2Н20+02)
Таким образом, О2, поступающий в митохондрии в процессе дыхания организма, необходим для присоединения протонов водорода Н. При его отсутствии весь процесс в митохондриях прекращается, так как электронно-транспортная цепь перестает функционировать. Общая реакция III этапа:
(2СзНбОз + 6Oз + 36АДФ + 36Ф ---> 6С02 + 36АТФ + +42Н20)
В результате расщепления одной молекулы глюкозы образуются 38 молекул АТФ: на II этапе - 2 АТФ и на III этапе - 36 АТФ. Образовавшиеся молекулы АТФ выходят за пределы митохондрии и участвуют во всех процессах клетки, где необходима энергия. Расщепляясь, АТФ отдает энергию (одна фосфатная связь заключает 40 кДж) и в виде АДФ и Ф (фосфата) возвращается в митохондрии.
Биологическая химия Лелевич Владимир Валерьянович
Строение АТФ-синтазы
Строение АТФ-синтазы
АТФ-синтаза – интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи и обозначается как V комплекс. АТФ-синтаза состоит из 2 субъединиц, обозначаемых как F 0 и F 1 . Гидрофобный комплекс F 0 погружен во внутреннюю мембрану митохондрий и состоит из нескольких протомеров, образующих канал по которому протоны переносятся в матрикс. Субъединица F 1 выступает в митохондриальный матрикс и состоит из 9 протомеров. Причем три из них связывают субъединицы F 0 и F 1 , образуя своеобразную ножку и являются чувствительными к олигомицину.
Суть хемиоосмотической теории: за счет энергии переноса электронов по ЦТД происходит движение протонов через внутреннюю митохондриальную мембрану в межмембранное пространство, где создается электрохимический потенциал (??Н +), который приводит к конформационной престройке активного центра АТФ-синтазы, в результате чего становится возможным обратный транспорт протонов через протонные каналы АТФ-синтазы. При возвращении протонов назад электрохимический потенциал трансформируется в энергию макроэргической связи АТФ. Образовавшаяся АТФ с помощью белка-переносчика транслоказы перемещается в цитозоль клетки, а взамен в матрикс поступают АДФ и Ф н.
Коэффициент фосфорилирования (Р/О) – число атомов неорганического фосфата, включенных в молекулы АТФ, в пересчете на один атом использованного поглощенного кислорода.
Пункты фосфорилирования – участки в дыхательной цепи, где энергия транспорта электоронов используется на генерацию протонного градиента, а затем в ходе фосфорилирования запасается в форме АТФ:
1. 1 пункт – между пиридинзависимой и флавинзависимой дегидрогеназами; 2 пункт – между цитохромами b и с 1 ; 3 пункт – между цитохромами а и а 3 .
2. Следовательно, при окислении НАД-зависимых субстратов коэффициент Р/О равен 3, так как электроны от НАДН транспортируются с участием всех комплексов ЦТД. Окисление ФАД-зависимых субстратов идет в обход I комплекса дыхательной цепи и Р/О равен 2.
Из книги Стоматология собак автора Фролов В ВСтроение зуба Зубы – органы ротовой полости, выполняющие различные функции, главной из которых является механическая обработка корма. Общий план структуры зубов характерен для обеих генераций (молочной и постоянной). Анатомически в зубе различают коронку, шейку и
Из книги Экология [Конспект лекций] автора Горелов Анатолий АлексеевичТема 1. СТРОЕНИЕ ЭКОСИСТЕМ
Из книги Возрастная анатомия и физиология автора Антонова Ольга Александровна9.1. Строение пищеварительного канала Пищеварительный канал состоит из системы органов, которые производят механическую и химическую обработку пищи и ее всасывание. У человека пищеварительный канал имеет вид трубки длиной 8-10 м. Стенка пищеварительной трубки состоит из
Из книги Тесты по биологии. 6 класс автора Бенуж ЕленаКЛЕТОЧНОЕ СТРОЕНИЕ ОРГАНИЗМОВ СТРОЕНИЕ КЛЕТКИ. ПРИБОРЫ ДЛЯ ИССЛЕДОВАНИЯ СТРОЕНИЯ КЛЕТКИ 1. Выберите один наиболее правильный ответ.Клетка – это:A. Мельчайшая частица всего живогоБ. Мельчайшая частица живого растенияB. Часть растенияГ. Искусственно созданная единица для
Из книги Биология [Полный справочник для подготовки к ЕГЭ] автора Лернер Георгий ИсааковичСТРОЕНИЕ И МНОГООБРАЗИЕ ПОКРЫТОСЕМЕННЫХ РАСТЕНИЙ СТРОЕНИЕ ЦВЕТКОВЫХ
Из книги Тропическая природа автора Уоллес Альфред Рассел Из книги Мир микробов автора Смородинцев Анатолий Александрович Из книги Путешествие в страну микробов автора Бетина Владимир Из книги Основы психофизиологии автора Александров Юрий Из книги Как возникла и развилась жизнь на Земле автора Гремяцкий Михаил АнтоновичСтроение Колибри образуют весьма цельное семейство Trochilidae. Они малы; самые крупные – не больше ласточки, самые мелкие – крошечные создания, не крупнее шмеля. Они отличаются очень коротенькими ножками и маленькими лапками, очень длинными острыми крыльями, длинным тонким
Из книги Тайны человеческого мозга автора Епифановская Наталья2. Строение и жизнь микробов Итак, микробами называются мельчайшие живые организмы, невидимые простым глазом. Как мы узнали из предыдущей главы, к микробам относятся разнообразные формы живой материи, имеющие как клеточную, так и неклеточную организацию.Различают
Из книги Yerba Mate: Мате. Матэ. Мати. 9000 лет парагвайского чая автора Колина АугустоСтроение ВТМ Вирус табачной мозаики изучен гораздо лучше других вирусов. Его размеры и форма нам уже хорошо известны. Но каково внутреннее строение частицы этого вируса?Рибонуклеиновая кислота находится в вирусной частице в виде простых спиралей, которые скрыты в
Из книги автора2. НЕЙРОН. ЕГО СТРОЕНИЕ И ФУНКЦИИ Мозг человека состоит из 10 12 нервных клеток. Обычная нервная клетка получает информацию от сотен и тысяч других клеток и передаёт сотням и тысячам, а количество соединений в головном мозге превышает 10 14 - 10 15 . Открытые более 150 лет тому назад
Из книги автораV. Состав и строение живых тел Наблюдая жизнь растений, животных и человека, мы видим, что с ними непрестанно совершаются самые разнообразные перемены: они растут, размножаются, стареют, умирают. Внутри них постоянно движутся разные соки, газы, пища и пр. Поступающие в
Из книги автораГлава 1. Строение мозга Мозг человека – самый сложный и загадочный орган тела. Для того чтобы его понять, человечеству пришлось потратить несколько столетий, но чем дальше мы продвигаемся в изучении, тем больше возникает новых вопросов. По большому счету, мозг
Из книги автораИстория, легенда и строение Бомбилья, она же бомбижья, бомбиша, момбиша, бомба (в Бразилии), масасса (в Сирии и Ливане) – это трубочка, через которую пьют мате. Бомбилья может быть бамбуковой, тростниковой, одноразовой пластмассовой, но чаще всего она металлическая. В