Para analizar una sustancia, primero debe aislarse, es decir, claro, porque Las propiedades de una sustancia dependen de su pureza. Cuando se aísla una sustancia de una mezcla de sustancias, a menudo se usa su diferente solubilidad en agua o solventes orgánicos.
recristalización- purificación de sólidos, basada en el aumento de la solubilidad de los sólidos al aumentar la temperatura en un disolvente dado. La sustancia se disuelve en agua destilada o en un disolvente orgánico adecuado a una determinada temperatura elevada. Se introduce una sustancia cristalina en el disolvente caliente en pequeñas porciones hasta que deja de disolverse, es decir se forma una solución saturada a la temperatura dada. La solución caliente se filtra en un embudo de filtración caliente a través de un filtro de papel o, si el disolvente es un líquido agresivo, a través de un filtro Schott (embudos con placa de vidrio poroso sellada). En este caso, la solución se libera de partículas sólidas finas suspendidas.
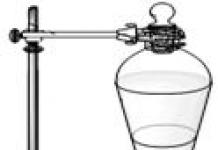
El filtrado se recoge en un vaso de precipitados colocado en un cristalizador con agua fría con hielo o con una mezcla refrigerante. Cuando se enfría, pequeños cristales del soluto precipitan de la solución saturada filtrada, porque. la solución se sobresatura a temperaturas más bajas. Los cristales precipitados se filtran en un embudo Buechner. La filtración al vacío se utiliza para acelerar la filtración y liberar más completamente el precipitado de la solución. Para este propósito, se ensambla un aparato de filtración al vacío (Fig. 15.1). Consta de un matraz Bunsen (1), un embudo de porcelana Buchner (2), una botella de seguridad (4) y una bomba de vacío de chorro de agua (10). En este caso, las impurezas solubles ingresan al filtrado, que no cristaliza junto con la sustancia principal, porque. la solución no estaba sobresaturada con respecto a las impurezas.
Arroz. 15.1. Planta de filtración al vacío. 1 - matraz Bunsen, 2 - embudo Buchner, 3 - tapón de goma con orificio, 4 - matraz, 5 - válvula de conexión, 6 - tubo de salida de gas de vidrio, 7 - tapón de goma con tres orificios, 8, 11 - manguera de goma, 9 - manguera PVC, 10 - bomba de chorro de agua
Los cristales filtrados, junto con el filtro del embudo Buchner, se transfieren a una hoja de papel de filtro doblada por la mitad y apretada entre hojas de papel de filtro. Repito la operación varias veces, luego los cristales se transfieren a la botella. La sustancia se lleva a masa constante en un horno eléctrico a una temperatura de 100 a 105 °C.
Sublimación - Este método se utiliza para purificar sustancias capaces de cambiar de un estado sólido a un estado gaseoso cuando se calientan, sin pasar por el estado líquido. Además, los vapores de la sustancia a purificar se condensan y las impurezas que no pueden sublimar se separan. Sustancias como el yodo cristalino, el cloruro de amonio (amoníaco) y la naftalina se subliman fácilmente. Sin embargo, este método de purificación de sustancias es limitado, porque. pocos sólidos son capaces de sublimar.
Separación de dos líquidos inmiscibles, que tienen diferentes densidades y no forman emulsiones estables, se puede hacer usando un embudo de decantación (Fig. 15.2). Así se puede separar, por ejemplo, una mezcla de benceno y agua. Una capa de benceno (densidad r = 0,879 g/cm 3 ) se encuentra encima de una capa de agua, que tiene una densidad alta (r = 1,0 g/cm 3). Al abrir la llave de paso del embudo de separación, puede drenar con cuidado la capa inferior y separar un líquido de otro.

Arroz. 15.2. embudo de separación.
Para separar sustancias líquidas (la mayoría de las veces orgánicas), se utiliza su solubilidad en disolventes inmiscibles. Después de sedimentar en un embudo de decantación, las capas de disolvente se separan por drenaje una a una. A continuación, el disolvente se evapora o se elimina por destilación. Para purificar sustancias orgánicas, se suelen utilizar varios tipos de destilación: fraccionada, con vapor, a baja presión (al vacío).
Destilación fraccionada(Fig. 15.3) se utiliza para separar mezclas de líquidos con diferentes puntos de ebullición. Un líquido con un punto de ebullición más bajo hierve más rápido y pasa a través de una columna de fraccionamiento (o desflemador). Cuando este líquido llega a la parte superior de la columna de fraccionamiento, entra nevera, enfriado por agua y alargar ir a receptor(frasco o probeta).

Arroz. 15.3 Instalación para destilación fraccionada: 1 - termómetro; 2 - desflemador; 3 - refrigerador; 4 - largo; 5 - receptor; 6 - matraz de destilación; 7 - capilares; 8 - calentador.
La destilación fraccionada puede separar, por ejemplo, una mezcla de etanol y agua. El punto de ebullición del etanol es de 78°C y el del agua es de 100°C. El etanol se evapora con más facilidad y es el primero en pasar por el frigorífico hasta el receptor.
Cromatografía (adsorción)- un método para separar mezclas, propuesto en 1903 por M.S. Color. Al ser un método físico y químico universalmente reconocido, la cromatografía le permite separar, así como realizar un análisis cualitativo y cuantitativo de una amplia variedad de mezclas. Los métodos cromatográficos se basan en una amplia gama de procesos físicos y químicos: adsorción, distribución, intercambio iónico, difusión, etc. La separación de la mezcla analizada se realiza a menudo en columnas llenas de gel de sílice, óxido de aluminio, intercambiadores de iones (resinas de intercambio iónico) o en papel especial. Debido a la diferente capacidad de absorción de los componentes determinados de la mezcla (fase móvil), se produce su distribución zonal sobre la capa absorbente (fase estacionaria): aparece un cromatograma que permite aislar y analizar sustancias individuales.
Una vez que el compuesto ha sido purificado, puede comenzar el análisis cualitativo. Para determinar la composición de la materia orgánica, se establece qué elementos se incluyen en su composición. Para esto, los elementos de la composición de esta sustancia se transfieren a sustancias inorgánicas bien conocidas y se descubren por los métodos de química inorgánica y analítica.
Purificación de sales solubles por recristalización . El método de recristalización se basa en la diferente dependencia de la solubilidad de las sustancias y las impurezas con la temperatura. La purificación de una sustancia por recristalización se lleva a cabo de acuerdo con el siguiente esquema: se prepara una solución saturada de la sustancia a purificar a temperatura elevada, luego, para eliminar las impurezas insolubles, la solución se filtra a través de un embudo de filtración caliente y se enfría a una temperatura baja A medida que desciende la temperatura, disminuye la solubilidad de la sustancia y precipita la mayor parte de la sustancia purificada, quedan impurezas solubles en la solución, ya que la solución permanece insaturada con respecto a ellas. Los cristales precipitados se separan de las aguas madres y se secan.
Dependiendo de las propiedades de la sustancia a purificar, son posibles varios métodos de recristalización.
Recristalización sin eliminación de disolvente. El método se utiliza para sales, cuya solubilidad depende en gran medida de la temperatura (por ejemplo, nitrato de sodio, alumbre de potasio, sulfato de cobre (II), etc.). La solución después de la filtración en caliente se enfría en aire a baja temperatura, los cristales precipitados se filtran. También es posible realizar una recristalización sin eliminar el disolvente de las sales, cuya solubilidad depende poco de la temperatura. En este caso, se utiliza el método de salado. Para hacer esto, la solución después de la filtración en caliente se enfría a temperatura ambiente y se agrega una solución de igual volumen de ácido clorhídrico concentrado, mientras que la sustancia a purificar precipita.
Recristalización con eliminación de disolvente. El método se utiliza para sales, cuya solubilidad depende poco de la temperatura (por ejemplo, cloruro de sodio, etc.). Después de la filtración en caliente, la solución se transfiere a un plato de porcelana pesado y se evapora en un baño de agua hasta aproximadamente la mitad del volumen. A continuación, la solución se enfría a temperatura ambiente. Los cristales precipitados se filtran.
La sustancia recristalizada (a excepción del cloruro de amonio y los hidratos cristalinos) se seca en estufa hasta peso constante. El cloruro de amonio y los hidratos cristalinos se secan al aire. Las sales secas se colocan en botellas selladas.
Purificación de sustancias volátiles por sublimación (sublimación) . El método se utiliza para purificar sólidos capaces de pasar directamente de la fase sólida a la fase gaseosa cuando se calientan, sin pasar por la fase líquida. El gas resultante es condensado por la parte enfriada del dispositivo. La sublimación generalmente se lleva a cabo a una temperatura cercana al punto de fusión de la sustancia. El método es aplicable para la purificación de impurezas que no pueden sublimar. La sublimación puede purificar yodo, azufre, cloruro de amonio.
Purificación de líquidos por destilación . El método se basa en el hecho de que cada sustancia tiene un punto de ebullición determinado. La versión más simple de destilación es la destilación a presión ordinaria, que consiste en calentar un líquido hasta que hierva y condensar sus vapores. La destilación se lleva a cabo en un aparato que consiste en un matraz Wurtz (o un matraz de fondo redondo con un tubo de salida de gas), un condensador recto, un matraz receptor, un alonge, un termómetro y un calentador. El líquido contaminado se calienta en un matraz de destilación hasta el punto de ebullición, los vapores se trasladan a un frigorífico y el líquido condensado se recoge en un receptor.
Los métodos para limpiar sustancias son diferentes y dependen de las propiedades de las sustancias y su aplicación. En la práctica química, los siguientes métodos son los más comunes: filtración, recristalización, destilación, sublimación y salado. La depuración de gases se suele realizar mediante la absorción de impurezas gaseosas por sustancias que reaccionan con estas impurezas. Las sustancias puras tienen propiedades físicas y químicas características inherentes. Por lo tanto, el grado de pureza de una sustancia se puede comprobar tanto por métodos físicos como químicos. En el primer caso se determinan las temperaturas de densidad, fusión, ebullición, congelación, etc.. Los métodos de verificación química se basan en reacciones químicas y son métodos de análisis cualitativos.
De acuerdo con el estándar (GOST), según el grado de pureza, los reactivos se dividen en:
a) químicamente puro (químicamente puro),
b) puro para análisis (grado analítico),
c) limpio (h.) y otros.
Las sustancias etiquetadas como químicamente puras son adecuadas para el trabajo de laboratorio en química inorgánica. y h.d.a.
- recristalización
Para recristalizar una sustancia, se disuelve en agua destilada o en un disolvente orgánico adecuado a una temperatura determinada. Se introduce una sustancia cristalina en el disolvente caliente en pequeñas porciones hasta que deja de disolverse, es decir se forma una solución saturada a la temperatura dada. La solución caliente se filtra en un embudo de filtración caliente. El filtrado se recoge en un vaso de precipitados colocado en un cristalizador con agua fría con hielo o con una mezcla refrigerante. Al enfriarse, precipitan pequeños cristales de la solución saturada filtrada, ya que la solución se sobresatura a temperaturas más bajas. Los cristales precipitados se filtran en un embudo Buchner, luego se transfieren a una hoja de papel de filtro doblada por la mitad. Extienda los cristales uniformemente con una varilla de vidrio o una espátula, cubra con otra hoja de papel de filtro y apriete los cristales entre las hojas de papel de filtro. La operación se repetirá varias veces. Luego, los cristales se transfieren a una botella. La sustancia se lleva a masa constante en un horno eléctrico a una temperatura de 100-105 . La temperatura en el gabinete hasta este límite debe aumentarse gradualmente. Para obtener una sustancia muy pura, la recristalización se repite varias veces.
- Sublimación (sublimación)
- Destilación (destilación)
- a) a presión atmosférica (destilación simple),
- b) a presión reducida (destilación al vacío),
- c) destilación al vapor.
- salando
La salazón consiste en que bajo la acción de cantidades significativas de una solución saturada de un electrolito fuerte, los compuestos naturales de alto peso molecular (proteínas, gomas, mocos, pectinas) se precipitan de los extractos. Esto se debe a que cuando se agrega una solución de electrolitos al extracto, los iones de electrolitos resultantes se hidratan y eliminan el agua de las moléculas del biopolímero. La capa protectora hidratada de moléculas de biopolímero desaparece. Se observa cohesión de partículas y deposición del biopolímero. La salazón se usa ampliamente para purificar fármacos proteicos, como la pepsina. El término "salado" obtuvo su nombre del proceso de precipitación de proteínas cuando se agrega cloruro de sodio a sus soluciones.
Debe tenerse en cuenta que diferentes sales tienen diferentes propiedades de salado, lo que se explica por la capacidad de hidratación de los aniones y cationes. La capacidad de formación de sales de los electrolitos depende principalmente de los aniones. De acuerdo con su fuerza de salificación, los aniones se ubican en la siguiente serie liotrópica >>>>>.
Para los cationes existe la misma serie liotrópica: > > > > .
Sin embargo, el cloruro de sodio, que es más económico, suele tener la mayor actividad de formación de sales.
- Cloruro de sodio
Cloruro de sodio - compuesto químico NaCl, sal de sodio del ácido clorhídrico, cloruro de sodio.
El cloruro de sodio se conoce en la vida cotidiana con el nombre de sal de mesa, de la que es el componente principal. El cloruro de sodio se encuentra en cantidades significativas en el agua de mar, lo que le da un sabor salado. Ocurre naturalmente como el mineral halita (sal de roca).
El cloruro de sodio puro tiene la apariencia de cristales incoloros. Pero con diversas impurezas, su color puede adquirir: azul, violeta, rosa, amarillo o gris.
Es moderadamente soluble en agua, la solubilidad depende poco de la temperatura: el coeficiente de solubilidad del NaCl (en g por 100 g de agua) es de 35,9 a 21 °C y de 38,1 a 80 °C. La solubilidad del cloruro de sodio se reduce significativamente en presencia de cloruro de hidrógeno, hidróxido de sodio, sales, cloruros metálicos. Se disuelve en amoníaco líquido, entra en reacciones de intercambio.
- Cloruro de sodio llamado "sal de mesa"
La sal de mesa (cloruro de sodio, NaCl; también se utilizan los nombres "cloruro de sodio", "sal de mesa", "sal de roca", "sal comestible" o simplemente "sal") es un producto alimenticio. En forma molida son pequeños cristales blancos. La sal de mesa de origen natural casi siempre tiene impurezas de otras sales minerales, que pueden darle tonalidades de diferentes colores (generalmente grises). Se produce en diferentes formas: purificada y sin refinar (sal de roca), molienda gruesa y fina, pura y yodada, sal marina, etc. La sal se produce mediante la limpieza industrial de los depósitos de halita (sal de roca) extraídos de mares secos.
- El cloruro de sodio se presenta naturalmente como el mineral halita.
Halita (griego ??? - sal) - sal de roca, un mineral de la subclase de cloruro, una forma cristalina de cloruro de sodio (NaCl). Materia prima con la que se elabora la sal de mesa. Las halitas se pueden encontrar en capas de rocas sedimentarias, entre otros minerales, productos de la evaporación del agua, en estuarios, lagos y mares secos. La capa sedimentaria tiene un espesor de hasta 350 metros y se extiende sobre vastas áreas. Por ejemplo, en Estados Unidos y Canadá, los depósitos subterráneos de sal se extienden desde las montañas Apalaches al oeste de Nueva York a través de Ontario hasta la cuenca de Michigan.
- Purificación de cloruro de sodio por salado.
Cuando se recristalizan sustancias cuya solubilidad cambia poco con la temperatura, se usa el método de salificación. Las sustancias que reducen su solubilidad se agregan a las soluciones de dichas sustancias.
- parte experimental
Dispositivos: balanzas tecnoquímicas, mortero, vidrio, teja, filtros plegados y ordinarios, vaso de precipitados, varilla de vidrio, embudo, placa de Petri.
Reactivos: solución saturada de cloruro de sodio, sal de mesa, agua destilada, ácido clorhídrico concentrado (?= 1, 19 ) .
- Método de limpieza
- Realización de un experimento
Pesé 20 g de sal de mesa en la balanza tecnoquímica, la vertí en un vaso. Allí se añadieron 50 ml de agua destilada. Luego puso el vaso en la estufa y puso a hervir el contenido. La sal se ha despegado. Filtré la solución y la coloqué en una campana extractora. Allí, lentamente, con agitación, se comenzó a agregar ácido clorhídrico concentrado. Al mismo tiempo, la solubilidad del electrolito disminuye cuando se introduce en la solución otro electrolito con el mismo ion. Con la introducción de iones de cloro Cl? en una solución saturada de cloruro de sodio NaCl(c) > +Cl? el equilibrio se desplaza hacia la izquierda, dando como resultado cristales de sal que no contienen impurezas.
Espere a que la solución se enfríe. La solución enfriada se filtró. Los cristales resultantes se colocaron en una placa de Petri y se dejaron secar.
Después de que los cristales se secaron, los pesé: m=5.200 g.
etc.................
Lección 8 REACTIVOS QUÍMICOS Y MÉTODOS PARA SU LIMPIEZA
valor del tema
El análisis en el laboratorio es imposible sin el uso de químicos llamados reactivos. El número de sustancias diferentes utilizadas en el análisis es enorme. El conocimiento de las propiedades de los reactivos, las reglas para su almacenamiento y el trabajo con ellos es necesario en el trabajo diario de un técnico de laboratorio médico. El laboratorio puede no tener un reactivo de la pureza deseada. Además, muchas sales que contienen agua de cristalización pierden parte de esta agua durante el almacenamiento. Las sustancias higroscópicas absorben el vapor de agua del aire durante el almacenamiento. Los reactivos como el alcohol, el benceno y el éter contienen más o menos agua. En todos estos casos, los reactivos se purifican.
saber:
Clasificación de reactivos químicos;
Reglas para el almacenamiento y uso de reactivos químicos;
Métodos para limpiar reactivos químicos de impurezas;
Dispositivo destilador, reglas de funcionamiento.
ser capaz de:
Purificar reactivos químicos por sublimación, recristalización;
Demostrar el funcionamiento del destilador.
Reactivos químicos (reactivos químicos o reactivos químicos) son productos químicos que se utilizan para análisis en investigación, trabajo de laboratorio. En teoría, sería genial utilizar reactivos químicos absolutamente puros (compuestos por un tipo de partículas) para la investigación, pero en la práctica, un reactivo puro se considera una sustancia que contiene la menor cantidad de impurezas que se puede lograr con la desarrollo moderno de la ciencia y la tecnología. Así, todos los reactivos químicos se pueden clasificar según su grado de pureza.
CLASIFICACIÓN DE REACTIVOS
Por grado de pureza
Característica
color de la franja de la etiqueta
Técnico
aquellos.
El contenido de la sustancia principal del 70%. Dichos reactivos contienen muchas impurezas y se utilizan para realizar trabajos auxiliares.
marrón claro
purificado
H.
el contenido de la sustancia principal del 98%. Dichos reactivos contienen solo un 2% de impurezas.
verde
Limpiar para el análisis
Grado analítico
el contenido de la sustancia principal es de alrededor del 99%, el % depende de la aplicación. Con la ayuda de tales reactivos, se llevan a cabo estudios analíticos precisos. Los reactivos contienen 0,5-1% de impurezas.
azul
químicamente puro
S.S.
El contenido del componente principal es del 99% y superior. No contienen más de 0.001-0.00001% de impurezas.
rojo
Para propósitos especiales:
Estos incluyen sustancias de alta pureza. El contenido del componente principal es casi del 100%. El contenido de impurezas es 10 -5 -10 -10 %.
espectralmente puro
w.p.h.
Pureza de referencia
e.h.
marrón
extra puro
Oh.
amarillo
por uso
Indicadores comunes
Tintes para microscopía,
Colorantes para cromatografía,
Reactivos para la desinfección.
tercero Por propiedades
A) Reactivos higroscópicos (sensibles a la humedad). La absorción de humedad puede La absorción de humedad puede ocurrir cuando el reactivo no está bien empaquetado y puede conducir no solo a la humectación de la sustancia, sino también a un cambio en sus propiedades.
B)fotosensible reactivos Algunas sustancias cambian bajo la influencia de la luz, entrando en reacciones de oxidación, reducción, isomerización, etc.
A)Reactivos inflamables. Estos incluyen compuestos que pueden entrar en contacto a corto plazo con una fuente de ignición (chispa, llama, filamento) o encenderse espontáneamente.
GRAMO)Venenoso reactivos Muchos productos químicos son más o menos venenosos. Especialmente peligrosa es la ingestión sistemática de compuestos que causan intoxicaciones crónicas (compuestos de mercurio, arsénico, ácido cianhídrico, mentol, etc.) en el cuerpo humano durante mucho tiempo. Incluso los compuestos que se usan a diario en grandes cantidades pueden ser tóxicos. Es necesario trabajar con tales sustancias solo en una campana de humos.
Ejemplos de reactivos pertenecientes a diferentes grupos
Grupos de reactivosEjemplos de reactivos
Convenciones
higroscópico
reactivos
hidróxidos de potasio y sodio, cloruro de amonio, anhídridos de ácido, etc.
Reactivos fotosensibles
solución de yodo, peróxido de hidrógeno, compuestos de plata.
inflamable
reactivos
líquidos inflamables (alcohol, acetona, benceno, éteres, etc.)
Reactivos tóxicos
compuestos de mercurio, arsénico, ácido cianhídrico, mentol, etc.
Etiquetas químicas
Todos los productos químicos en el laboratorio deben estar etiquetados.
¡La sustancia no se puede almacenar sin una etiqueta!
De acuerdo con GOST 3885-73, los reactivos (preparados) deben envasarse en recipientes de consumo apropiados, sellados herméticamente y provistos de una etiqueta estándar.
Para los reactivos de cada clasificación, la etiqueta del envase debe ser de un color determinado o debe tener una banda de color.
Si los reactivos tienen propiedades venenosas, inflamables y explosivas, se pega una etiqueta separada con una inscripción de un determinado color.
Ciertas sustancias están marcadas en las etiquetas con dibujos:
Métodos de escritura de etiquetas:
Etiquetas impresas
Universal con cinta adhesiva
Temporal (lápiz sobre vidrio)
Pinturas al óleo o barniz
Vapores de ácido fluorhídrico - "etiquetas eternas".
Reglas para el almacenamiento de productos químicos.
Se deben mantener pequeñas existencias de productos químicos en la sala del laboratorio. Se guardan en frascos, frascos con tapones de vidrio pulido o tapas de plástico de polietileno, y los más volátiles (ácido clorhídrico, solución de amoníaco, bromo) se guardan en estantes especiales en una campana extractora. El stock total de líquidos inflamables almacenados simultáneamente en cada sala de trabajo del laboratorio no debe exceder el requerimiento diario. Viales que contienen más de 50 ml. Los líquidos inflamables deben almacenarse en cajas de combustible de hierro con tapa hermética, con paredes y fondo revestidos de asbesto. Los reactivos sensibles a la luz se almacenan en botellas o frascos oscuros envueltos en papel negro. Los venenos fuertes deben almacenarse en gabinetes sellados y cajas fuertes. Está permitido almacenar reactivos solo en salas especialmente equipadas y bien ventiladas, en estricto orden. No se permite el almacenamiento conjunto de reactivos que puedan interactuar entre sí, por ejemplo, oxidantes y reductores, ácidos y álcalis.
Los siguientes grupos de reactivos deben almacenarse por separado:
explosivos,
gases combustibles y licuados,
Sustancias espontáneamente inflamables o autoinflamables,
venenos
Los reactivos que no requieren condiciones especiales de almacenamiento se colocan en gradillas. Las sustancias inorgánicas se ordenan según la conocida clasificación: sustancias simples (metales, no metales), óxidos, bases, sales. Las sales se organizan mejor por cationes. Los ácidos se almacenan por separado. Las sustancias orgánicas están convenientemente ordenadas alfabéticamente. Las normas y reglamentos para el almacenamiento de reactivos se desarrollan y aprueban por separado en cada organización, según las características del trabajo, la disponibilidad de equipos y las instalaciones de almacenamiento.
A la hora de almacenar productos químicos, la elección del corcho no deja de ser importante . Hay algunas cosas a tener en cuenta sobre los enchufes y cómo manejarlos:
La elección del corcho para la cristalería química se realiza en función del reactivo. Elige un corcho:
Primero debe recoger el corcho en el recipiente y solo luego poner las sustancias en él. No deben confundirse los tapones de diferentes recipientes; cada recipiente debe tener su propio tapón, especialmente tapones de vidrio.
Si el recipiente con el tapón en el suelo está vacío, es necesario colocar un trozo de papel entre el cuello y el tapón.
Si es necesario cerrar un recipiente con ácido o álcali con un tapón de corcho, primero se debe procesar el corcho.
Es imposible almacenar álcalis en recipientes con tapones esmerilados, ya que en este caso el tapón inevitablemente se "atasco".
Reglas para el uso de reactivos.
1. El principal requisito para los reactivos es su pureza. El reactivo debe protegerse de la contaminación.
2. No deseche ni drene el reactivo del recipiente en el que se lleva a cabo la reacción de vuelta al recipiente de almacenamiento.
3. No confunda los tapones de los platos con diferentes reactivos, y también almacene los reactivos sin tapones. Es necesario considerar estrictamente qué corcho cerrar botellas o frascos. Los tapones de goma no se pueden usar para cerrar botellas con reactivos tales como gasolina, queroseno, benceno, tolueno y otros hidrocarburos líquidos, así como dicloroetano, éter, etc., de cuyos vapores se hincha y ablanda la goma.
4. No puede tomar el reactivo con las manos.
5. Los bancos con sustancias volátiles deberán estar abiertos en el momento de su uso directo.
6. El trabajo con sustancias venenosas, malolientes e inflamables se lleva a cabo en una campana extractora.
7. Si es necesario determinar el olor, dirija cuidadosamente los vapores de la sustancia del recipiente hacia usted con la mano.
8. Los reactivos venenosos y cáusticos después del trabajo deben verterse en botellas especiales.
Reglas para trabajar con ácidos y álcalis.
Todas las soluciones concentradas deben almacenarse en botellas especiales con tapones esmerilados, sobre los cuales es necesario colocar una tapa esmerilada. Se recomienda almacenar los álcalis en frascos de boca ancha de vidrio naranja oscuro, cerrados con tapones de corcho o polietileno y rellenos con una capa de parafina.
Los ácidos y los álcalis deben almacenarse en los estantes inferiores de los gabinetes separados de los reactivos y las pinturas.
Los recipientes para el almacenamiento de sustancias tóxicas, álcalis y ácidos deben tener inscripciones claras (en tinta sobre vidrio o de otra manera).
Bixes, frascos, botellas con sustancias volátiles deben abrirse solo en el momento de su uso directo.
5. Recipientes abiertos con ácidos concentradosy álcalis y sustancias volátiles, y está permitido preparar soluciones a partir de ellos solo en una campana de humos con ventilación forzada encendida.
Los álcalis se deben sacar del frasco con una espátula.
Las botellas con ácidos, álcalis y otras sustancias cáusticas deben transportarse de a dos en cajas o cestas especiales o transportarse en un carro especial.
Al diluir ácidos fuertes, el ácido debe verterse en agua, y no al revés.
Cuando se trabaja con ácidos, álcalis, está prohibido aspirar el líquido en la pipeta con la boca. Para recolectar líquido, use perillas de goma con tubos.
Las soluciones para la neutralización de ácidos y álcalis concentrados deben estar en el estante (estante) durante toda la jornada laboral.
Los platos que contengan soluciones de sustancias cáusticas deben lavarse con guantes de goma para evitar quemaduras en las manos.
Precauciones de seguridad al trabajar con productos químicos
Los experimentos con sustancias tóxicas y malolientes se llevan a cabo en una campana extractora.
Para determinar el olor de un gas o líquido, inhale suavemente el aire, dirigiendo ligeramente el vapor del recipiente hacia usted con la mano.
Al verter los reactivos, no se incline sobre el recipiente para evitar salpicaduras en la cara y la ropa.
Todos los experimentos con sustancias inflamables se llevan a cabo en una campana de humos.
MÉTODOS DE PURIFICACIÓN DE REACTIVOS QUÍMICOS
Si el laboratorio no cuenta con un reactivo químico de cierto grado de pureza, debe ser purificado aún más. Los métodos de limpieza más comunes son:
filtración,
centrifugación,
recristalización,
destilación (destilación),
sublimación (sublimación),
absoluto (secado).
Purificación por decantación
Decantación - es el asentamiento de partículas sólidas contenidas en un líquido bajo la influencia de la gravedad. Luego de la decantación, el líquido clarificado se separa del sedimento de partículas sólidas; mientras elimina las impurezas. La ventaja del método es su simplicidad y la desventaja es la lenta sedimentación de las partículas pequeñas. Mucho más rápida es la separación de una mezcla de partículas líquidas y sólidas por centrifugación.
Purificación por centrifugación
centrifugaciónbasado en el uso de la fuerza centrífuga que ocurre durante la rotación rápida. En las centrífugas de laboratorio convencionales, la velocidad de rotación es de aproximadamente 1000 rpm y, en especial (ultracentrífugas), hasta 6000 rpm. La fuerza de gravedad artificial en las centrífugas supera la gravedad de la tierra de decenas a cientos de miles de veces, como resultado de lo cual las partículas sólidas se asientan en unos pocos minutos.
Limpieza de filtros
Filtración consiste en pasar la suspensión a través de un tabique poroso, un filtro que atrapa las partículas sólidas. El filtro puede ser un papel especial, tela, cerámica porosa, vidrio poroso, una capa de arena y otros materiales porosos. En condiciones normales, la filtración es lenta. Para acelerarlo, se realiza al vacío: se crea un vacío en el receptor de líquido mediante una bomba, como resultado de lo cual la presión atmosférica comienza a actuar sobre el líquido por encima del filtro, y cuanto mayor sea la diferencia de presión (atmosférica y en el receptor), más rápida es la filtración.
Purificación por recristalización
La recristalización se usa para purificar varias sales solubles y muchos sólidos orgánicos. La recristalización es uno de los métodos más comunes para la purificación y separación de sustancias cristalinas. Este método se basa en la diferente solubilidad de una sustancia en un solvente frío y caliente y en la diferente solubilidad de los componentes de una mezcla en el mismo solvente.
El proceso de recristalización incluye varias etapas:
1. Elección del solvente. La elección se hace empíricamente. El disolvente debe cumplir los siguientes requisitos:
1) no interactúan con la sustancia,
2) no disuelva la sustancia a temperatura ambiente y se disuelva bien cuando se calienta,
3) cuando la solución caliente se enfría, los cristales deben caer,
4) disolver bien las impurezas a temperatura ambiente o no disolverlas al hervir,
5) el punto de ebullición del solvente debe ser inferior al punto de fusión de la sustancia en 10-15ºС,
6) el solvente debe eliminarse fácilmente de la superficie de los cristales durante el lavado y secado.
2. Saturado en el punto de ebullición del disolventesolución .
3. Filtración de solución caliente a través de un filtro plegado para eliminar las impurezas mecánicas.
4. Enfriando la solución causando la cristalización. . El enfriamiento se lleva a cabo a tal velocidad que caen cristales de tamaño mediano. Por lo general, la solución se deja reposar a temperatura ambiente durante 20 a 30 minutos y luego se coloca en un baño de hielo. Si los cristales no se caen, puede poner un cristal de esta sustancia en la solución ("semilla") o frotarlo con una varilla de vidrio en la pared interna del vaso con la solución.
5. Separación de cristales de las aguas madres. (filtración a presión reducida).
6. Lavar los cristales con disolvente frío . Si la sustancia es prácticamente insoluble a temperatura ambiente, entonces los cristales se pueden lavar con un solvente a temperatura ambiente.
7. Cristales de secado . Los cristales se secan normalmente al aire o en un cristalizador al vacío.
Las instalaciones para llevar a cabo todas las etapas de recristalización se muestran en la Figura No. 4
1- Instalación para la preparación de una solución saturada (a - matraz de fondo redondo, b - condensador de reflujo, c - estufa)
2- Instalación para filtración en caliente (a - vidrio, b - embudo químico, c - filtro plisado)
3- Instalación para filtrado a presión reducida (a - filtro Schott, b - matraz Bunsen)
Purificación por destilación o destilación.
destilación o destilación - uno de los métodos más importantes de purificación de líquidos. Durante la destilación, el líquido se convierte en vapor por calentamiento, luego se condensa nuevamente, es decir, se convierte en líquido. En este caso, todas las impurezas sólidas y las impurezas líquidas de mayor punto de ebullición permanecen en el matraz, y las impurezas de menor punto de ebullición se eliminan por destilación antes que el líquido principal. La destilación purifica el agua y otros líquidos. Se introduce un embudo con un tubo largo en el matraz Wurtz (1) y se vierte con cuidado el líquido a destilar, se lanzan varios capilares con un extremo sellado (el extremo sellado debe quedar por encima del líquido), esto es necesario para una ebullición uniforme . Cerrar el cuello del matraz con un tapón con termómetro (2). Después de eso, sustituya el receptor por el destilado (5) y comience a calentar.
Cuando la destilación debe ser monitoreada cuidadosamente. Para que el líquido hierva uniformemente y no hierva. La destilación no debe ser demasiado rápida. Tan pronto como el líquido hierva, controle cuidadosamente las lecturas del termómetro. La primera pequeña porción del destilado son impurezas. Cuando las lecturas del termómetro corresponden al punto de ebullición de la sustancia destilada, se sustituye por otro receptor, donde se recoge la sustancia destilada. La destilación se completa cuando queda una pequeña cantidad de líquido en el matraz Wurtz. No se permite el funcionamiento en seco.
De gran importancia en el laboratorio es la destilación del agua, ya que todas las soluciones se preparan únicamente con agua destilada. También se utiliza en grandes cantidades para otros fines. Los destiladores se utilizan para obtener agua destilada en los laboratorios.
Purificación por sublimación.
Algunos sólidos, como el yodo, tienen la capacidad de solidificarse cuando se calientan sin derretirse. Este fenómeno se denomina sublimación o sublimación. La sublimación se utiliza para purificar sustancias de impurezas no volátiles. Este método permite purificar yodo, cloruro de amonio, azufre, etc. Para purificar pequeñas cantidades de una sustancia por sublimación se utilizan dos vidrios de reloj del mismo tamaño esmerilados entre sí. Se coloca una sustancia sublimable sobre el vidrio inferior y se sujeta entre los vidrios un círculo de papel de filtro, perforado en varios lugares, cuyo propósito es evitar que los cristales formados caigan sobre el vidrio inferior calentado. El vaso inferior se calienta en un baño de arena o con mucho cuidado, con una pequeña llama, sobre una rejilla de amianto; el vaso superior se enfría con un trozo de papel de filtro húmedo.
La sublimación de grandes cantidades de una sustancia se lleva a cabo en un vaso calentado en un baño de aceite o aire. Un matraz enfriado desde el interior con agua corriente se baja al vaso, en cuya superficie se asientan los cristales de la sustancia sublimada.
Deshidratación de reactivos orgánicos.
Cuando se trabaja en el laboratorio, a menudo es necesario purificar varios solventes (alcohol, éter, benceno, etc.). Todos estos reactivos contienen agua en cantidades variables, cuya presencia puede interferir con el trabajo. Por lo tanto, estos reactivos se secan antes de ser destilados. Los líquidos purificados de esta manera se llaman absolutos. Dado que los reactivos orgánicos tienen diferentes propiedades, los métodos para secarlos son diferentes.
Absolutización del alcohol.
Para secar el alcohol, se coloca sulfato de cobre deshidratado CuSO4 en un matraz de fondo redondo y se vierte el alcohol. El matraz se conecta a un condensador de reflujo, que se cierra con un tapón con un tubo de cloruro de calcio. El cloruro de calcio calcinado se coloca en un tubo de cloruro de calcio para absorber el vapor de agua del aire. El dispositivo se instala en un baño de agua y se hierve durante 6-8 horas. Al final de la ebullición, el condensador de reflujo se reemplaza por un condensador Liebig y el alcohol se destila en un matraz limpio. El dispositivo durante la destilación está cuidadosamente protegido contra la entrada de humedad en el aire.
Absolutización del benceno.
El cloruro de calcio calcinado se coloca en benceno, se tapa con corcho y se deja reposar durante un día. Filtrar y agregar finamente picado, bien purificado de queroseno y película de óxido, sodio metálico. Montar el aparato a reflujo y hervir durante 3-4 horas en un baño de arena. Después de eso, el benceno se destila sobre sodio, protegiéndolo cuidadosamente de la humedad del aire. Está estrictamente prohibido calentar benceno con sodio metálico en un baño de agua o quemador de gas. Absolutización del éter. El éter almacenado durante mucho tiempo puede contener impurezas de peróxido de dioxetilo. Por lo tanto, en primer lugar, el éter se agita vigorosamente en un embudo de separación con una solución concentrada de hidróxido de sodio o potasio. El éter separado del álcali se agita en un embudo de decantación con una parte igual de agua y se separa del agua. Después de lavar el éter con agua, se le añade cloruro de calcio calcinado y se deja reposar durante un día. Luego se filtra el éter, se agrega sodio metálico finamente picado, se somete a reflujo como en la deshidratación del benceno y se destila por calentamiento en un baño de arena.
Preguntas para la autopreparación:
1. ¿En qué grupos se dividen los reactivos químicos según sus propiedades? Dar ejemplos.
2. ¿Características del almacenamiento de varios grupos de reactivos químicos?
3. Cuáles son las reglas básicas para el uso de reactivos químicos.
4. ¿Cómo se deben seleccionar los tapones para el almacenamiento de varios reactivos químicos?
5. ¿Qué significan los símbolos en las etiquetas de los productos químicos?
6. Métodos de limpieza de reactivos químicos.
Trabajo independiente:
Preparar un resumen sobre el tema “Tipos de destilación. Términos y condiciones"
Ensayo “Reactivos químicos. Métodos de limpieza.»
1. Marca de reactivo, en el que el contenido de impurezas no supera el 0,5-1%
a) h. b) químicamente puro c) h.f.a. d) tecnología.
2. El hidróxido de sodio, el hidróxido de potasio y el óxido de calcio pertenecen al grupo de sustancias
a) higroscópico b) fotosensible c) inflamable d) venenoso
3. Propiedades de los compuestos de mercurio, arsénico, ácido cianhídrico, metanol
a) hidroscópico b) fotosensible c) inflamable d) venenoso
4. Se almacenan sustancias tóxicas
a) en una campana de humos b) en un gabinete sellado o caja fuerte c) en una caja de hierro junto con líquidos inflamables d) en estantes en un gabinete de laboratorio
5. Método de purificación de yoduro de potasio a partir de cristales de yodo
a) destilación b) sublimación c) destilación d) recristalización
6. Método para la purificación de nitrito de sodio a partir de impurezas químicas solubles
a) recristalización b) sublimación c) filtración d) destilación
7. Método de purificación para obtener agua destilada
a) destilación b) sublimación c) recristalización d) filtración
8. Matraz utilizado para destilación, destilación de líquidos.
a) cónico b) Wurtz c) de fondo redondo d) medido e) de fondo plano
9. Método de purificación de reactivos sólidos
a) recristalización b) filtración c) destilación d) centrifugación e) precipitación
10. Método de purificación de reactivos líquidos
a) recristalización b) sublimación c) destilación d) centrifugación e) precipitación
Tareas situacionales
1. Durante la limpieza general, el auxiliar de laboratorio derramó accidentalmente reactivo de yoduro de potasio y yodo. Escriba un procedimiento para la purificación de yoduro de potasio que contenga impurezas mecánicas y cristales de yodo.
2. Realice un procedimiento para la purificación de cloruro de sodio que contenga impurezas mecánicas y una mezcla de sulfato de sodio.
3. El laboratorio recibió un reactivo de hidróxido de potasio (técnico). Para estudios de laboratorio, el reactivo debe ser purificado. Inventar un procedimiento de purificación para KOH, que contiene impurezas mecánicas.
4. Elaborar un procedimiento de purificación de nitrato de sodio que contenga impurezas mecánicas y químicas.
Ejemplos de respuestas a las tareas
1. Primero, los cristales de yodo se aíslan de la mezcla por sublimación. El reactivo de yoduro de potasio y las impurezas mecánicas se disuelven en agua (se prepara una solución saturada), las impurezas mecánicas se filtran y los cristales de yoduro de potasio se evaporan.
2. Se disuelve en agua una mezcla de cloruro de sodio, sulfato de sodio e impurezas mecánicas. Para hacer esto, prepare una solución saturada caliente de cloruro de sodio con impurezas, filtre y enfríe.
3. La filtración se usa para purificar el reactivo de hidróxido de potasio de las impurezas mecánicas. Para ello, la mezcla se disuelve en agua, se filtra y luego se evaporan los cristales.
4. Se disuelve en agua una mezcla que contiene impurezas mecánicas y químicas. Para hacer esto, prepare una solución saturada caliente, filtre y luego enfríe.
trabajo de curso
Formas de limpiar productos químicos
disciplina: química inorgánica
Tver, 2013
Introducción
La separación y purificación de sustancias son operaciones que suelen ir unidas. La separación de una mezcla en componentes persigue con mayor frecuencia el objetivo de obtener sustancias puras, si es posible, sin impurezas. Sin embargo, el concepto mismo de qué sustancia debe considerarse pura aún no se ha establecido definitivamente, ya que los requisitos para la pureza de una sustancia están cambiando. En la actualidad, los métodos para la obtención de sustancias químicamente puras han adquirido especial relevancia.
La separación y purificación de sustancias a partir de impurezas se basan en el aprovechamiento de sus propiedades físicas, fisicoquímicas o químicas específicas.
La técnica de los métodos más importantes de separación y purificación de sustancias (destilación y sublimación, extracción, cristalización y recristalización, salado) se describe en los capítulos correspondientes. Estas son las técnicas más comunes, que se utilizan con mayor frecuencia no solo en la práctica de laboratorio, sino también en tecnología.
En algunos de los casos más difíciles, se utilizan métodos de limpieza especiales.
1. Purificación de sustancias
.1 Recristalización
La purificación por recristalización se basa en el cambio de solubilidad de una sustancia con un cambio de temperatura.
La solubilidad se entiende como el contenido (concentración) de un soluto en una solución saturada. Por lo general, se expresa como porcentaje o como gramos de soluto por 100 g de solvente.
La solubilidad de una sustancia depende de la temperatura. Esta dependencia se caracteriza por curvas de solubilidad. Los datos sobre la solubilidad de algunas sustancias en agua se dan en la fig. 1, así como en la tabla de solubilidad.
Según estos datos, si, por ejemplo, preparamos una solución de nitrato de potasio, tomando 100 g de agua, saturada a 45 º, y luego enfriarlo a 0 º, luego deben caer 60 g de cristales de KNO 3. Si la sal contuviera pequeñas cantidades de otras sustancias solubles en agua, no se alcanzará la saturación con respecto a ellas a la disminución de temperatura indicada, y por lo tanto no se caerán con los cristales de sal. Cantidades insignificantes de impurezas, a menudo no detectables por métodos de análisis convencionales, solo pueden ser eliminadas por cristales precipitados. Sin embargo, con recristalizaciones repetidas, se puede obtener una sustancia casi pura.
La solución salina saturada que queda después de filtrar los cristales precipitados, más puros son, ya que en este caso captan menos las aguas madres que contienen impurezas de otras sustancias. La reducción de impurezas se facilita lavando los cristales con un solvente después de separarlos de las aguas madres.
Así, la recristalización se reduce a la disolución de una sustancia en un disolvente adecuado y su posterior aislamiento de la solución resultante en forma de cristales. Este es uno de los métodos más comunes para eliminar las impurezas de las sustancias.
1.2 Sublimación
La sublimación, o sublimación, es la conversión directa de un sólido en vapor sin la formación de un líquido. Habiendo alcanzado la temperatura de sublimación, el sólido pasa sin fundirse en vapor, que se condensa en cristales en la superficie de los objetos enfriados. La sublimación siempre ocurre a una temperatura por debajo del punto de fusión de la sustancia.
Aprovechando la propiedad de una serie de sustancias (yodo, naftalina, ácido benzoico, amoníaco, etc.) para sublimar, es fácil obtenerla en forma pura si la impureza carece de esta propiedad.
Para un estudio más profundo del fenómeno de la sublimación, es necesario familiarizarse con el diagrama del estado de la materia, que se muestra en la Fig. 2. La temperatura t (en grados Celsius) se representa en el eje de abscisas, la presión de vapor saturado p (en m / cm 3). El diagrama de estado del agua tiene una forma similar, de modo que su curva TB está inclinada hacia el eje y, ya que el punto de congelación del agua disminuye al aumentar la presión.
La curva TA expresa la relación entre la temperatura y la presión de vapor de saturación sobre un líquido. Todos los puntos de la curva TA determinan las condiciones de equilibrio entre el líquido y su vapor saturado. Por ejemplo, a 100 º el agua y el vapor solo pueden existir a una presión de 760 mm Hg. Arte. Si la presión es superior a 760 mm Hg. Art., luego el vapor se condensa en agua (el área por encima de la curva TA); si la presión es inferior a 760 mm Hg. Art., entonces todo el líquido se convierte en vapor (el área debajo de la curva TA). La curva TA se encuentra por encima del punto de fusión de la sustancia. La curva TB expresa la relación entre la temperatura y la presión de vapor saturado sobre un sólido. La presión de vapor de los sólidos suele ser baja y depende en gran medida de la naturaleza del sólido y de la temperatura. Así, la presión de vapor del yodo a 16 º igual a 0,15 mm Hg. Art., hielo en - 15 º igual a 1,24 mm Hg. Arte. La curva TB se encuentra por debajo del punto de fusión de la sustancia. Todos los puntos de esta curva determinan las condiciones de equilibrio entre el cuerpo sólido y su vapor saturado.
La curva TB se denomina curva de fusión y expresa la relación entre el punto de fusión de una sustancia y la presión.
Todos los puntos de esta curva definen las condiciones (temperatura y presión) bajo las cuales el sólido y el líquido están en equilibrio.
Las curvas TA, TB y TV dividen el diagrama de estado de la materia en tres áreas: 1 - el área de existencia de la fase sólida, 2 - la fase líquida y 3 - la fase de vapor.
El punto T, donde convergen las tres regiones, indica la temperatura y la presión a las que las tres fases de la materia (sólido, líquido y vapor) pueden estar en equilibrio. Se llama triple punto(T).
Cambiando la temperatura o la presión, puedes cambiar el estado de la materia.
Sea el punto 1 el estado sólido de la materia a una presión superior al punto triple. Cuando una sustancia se calienta a presión constante, el punto 1 se moverá a lo largo de la línea de puntos 1-4 y, a cierta temperatura, cruzará la curva de fusión TB en el punto 2. Cuando todos los cristales se hayan derretido, el calentamiento adicional a presión constante conducirá a En el punto 3 de la curva TA, donde el líquido comienza a hervir, la sustancia pasará a estado de vapor. Con un mayor aumento de la temperatura, el cuerpo pasará del estado 3 al estado 4. El enfriamiento del vapor repetirá los procesos considerados en la dirección opuesta a lo largo de la misma curva punteada del estado 4 al estado 1.
Si tomamos una sustancia a una presión por debajo del punto triple, por ejemplo, en el punto 5, al calentar la sustancia a presión constante, llegaremos al punto 6, en el que el sólido se convertirá en vapor sin la formación preliminar de un líquido. , es decir. tendrá lugar la sublimación o sublimación (ver línea de puntos 5-7). Por el contrario, cuando el vapor se enfría a la misma presión, se producirá la cristalización de la sustancia en el punto 6 (también sin formación de líquido).
De lo anterior, se pueden extraer las siguientes conclusiones:
)Como resultado de calentar un sólido a una presión superior al punto triple, se derretirá;
)Como resultado de calentar un sólido a una presión por debajo del punto triple, se sublima;
)Si el calentamiento se lleva a cabo a la presión atmosférica, se producirá la sublimación si la presión del punto triple de una sustancia determinada es superior a la presión atmosférica. Entonces, por ejemplo, en p \u003d 1 atm, el dióxido de carbono se sublima en - 79 º, la fusión se hará siempre que el calentamiento se realice a una presión superior a la del punto triple.
Tenga en cuenta que los sólidos pueden vaporizarse a presiones superiores al punto triple (porque todos los sólidos y líquidos se vaporizan parcialmente a cualquier temperatura). Entonces, el yodo cristalino a presión atmosférica por debajo del punto de fusión se convierte en un vapor violeta, que se condensa fácilmente en cristales en una superficie fría. Esta propiedad se utiliza para purificar yodo. Sin embargo, dado que la presión del punto triple del yodo está por debajo de la presión atmosférica, se derretirá con más calor. Por lo tanto, el yodo cristalino a presión atmosférica no puede estar en equilibrio con su vapor saturado.
Solo los sólidos que están bajo presión por debajo del punto triple pueden estar en equilibrio con su vapor saturado. Pero a tal presión, estas sustancias no pueden derretirse. Las sustancias sublimables se pueden convertir en estado líquido calentándolas a cierta presión.
1.3 Destilación
La destilación, o destilación, se basa en la conversión de un líquido en vapor, seguida de la condensación del vapor en líquido. Este método separa un líquido de sólidos disueltos o líquidos menos volátiles. Así, por ejemplo, con la ayuda de la destilación, se purifica el agua natural de las sales que contiene. El resultado es agua destilada, desprovista de estas sales o que las contiene solo en cantidades extremadamente pequeñas.
Para la destilación de una pequeña cantidad de líquido en el laboratorio se utiliza un aparato de destilación.
Un líquido hierve cuando su presión de vapor se vuelve igual a la presión externa (generalmente atmosférica). Una sustancia pura a presión constante hierve a una temperatura estrictamente definida. Las mezclas hierven a varias temperaturas (indeterminadas). Por tanto, el punto de ebullición es una característica de la pureza de una sustancia. Cuanto más pura es la sustancia, menor es la diferencia entre el punto de ebullición de la sustancia y la temperatura a la que se destila. (una)
Con un aparato de destilación, las mezclas de líquidos se pueden separar y obtener en forma pura. La separación en este caso se basa en la diferencia en la composición de la mezcla líquida y su vapor saturado. Esto se ve claramente en el diagrama de la Fig. 3, que muestra la dependencia del punto de ebullición de una mezcla de dos líquidos (sustancias) A y B de la composición de la mezcla líquida y la composición del vapor con el que la mezcla líquida está en equilibrio. Las temperaturas de ebullición a presión constante se representan en el eje de ordenadas y la composición de la mezcla líquida o vapor se representa en el eje de abscisas. El punto inicial en el eje x corresponde a la sustancia A pura (100 % de sustancia A y 0 % de sustancia B), el punto final - a la sustancia B pura (100 % de sustancia B y 0 % de sustancia A), intermedio apunta - a varias mezclas de sustancias A y B, por ejemplo 50% A y 50% B; 80% A y 20% B, etc. Las ventajas de este método de representación son obvias. Se obtienen dos curvas en el diagrama: la curva de líquido (inferior) expresa la composición del líquido en ebullición, y la curva de vapor (superior) degenera la composición del vapor. Como puede verse, a todas las temperaturas, el vapor tiene una composición diferente a la del líquido, es decir siempre es más rico en el componente más volátil.
Del diagrama se deduce que la composición de la mezcla en el punto B al punto de ebullición t corresponde a la composición del vapor en el punto G*, y la composición de la mezcla en el punto D a la temperatura de ebullición t corresponde a la composición de el vapor en el punto E, es decir con un aumento en el contenido de líquido A en la mezcla, aumenta el contenido de A en vapor. Esto fue establecido por primera vez por D.P. Konovalov en 1881: con un aumento en la concentración de una sustancia en un líquido, aumenta su contenido en vapor (la primera ley de D.P. Konovalov). Por lo tanto, durante la destilación de tal mezcla de líquidos, las primeras porciones del destilado contendrán más líquido con una alta presión de vapor (es decir, bajo punto de ebullición) que en las porciones posteriores. En el matraz de destilación, durante el proceso de destilación, aumenta la cantidad de líquido de alto punto de ebullición.
Tal destilación, cuando el destilado se toma en diferentes rangos de temperatura y en diferentes receptores, se denomina destilación fraccionada o fraccionada. Los líquidos en recipientes, tomados en ciertos rangos de temperatura, se llaman fracciones.
Repitiendo la destilación fraccionada varias veces, es posible separar casi por completo una mezcla de líquidos y obtener los componentes de la mezcla en forma pura.
Una separación más completa y rápida de mezclas de líquidos por destilación fraccionada se ve favorecida por el uso de condensadores de reflujo o columnas de destilación. El vapor se condensa parcialmente en ellos antes de ser llevado al refrigerador, como resultado de lo cual la cantidad de fracción de bajo punto de ebullición en el líquido destilado aumenta considerablemente. Una de estas destilaciones (es decir, usando una columna de destilación o un condensador de reflujo) reemplaza varias destilaciones sucesivas realizadas usando un aparato de destilación.
La destilación a reflujo, así como otras técnicas de destilación, como la destilación al vapor, la destilación a presión reducida, se tratan en manuales y talleres de química orgánica.
2. Purificación de gases
solubilidad sustancia recristalización sublimación
La purificación del gas a partir de gases de impurezas se logra haciéndolo pasar por sustancias que absorben estas impurezas. Por ejemplo, cuando se obtiene dióxido de carbono en el dispositivo Kipp, salen impurezas: cloruro de hidrógeno (del ácido clorhídrico) y vapor de agua. Si el dióxido de carbono con estas impurezas se pasa primero a través de una botella de lavado con agua (para absorber el cloruro de hidrógeno) y luego a través de un tubo de cloruro de calcio (para absorber el vapor de agua), entonces el CO 2saldrá casi limpio.
Para determinar el grado de pureza de una sustancia, se utilizan métodos de investigación físicos y químicos. Los primeros incluyen: para sustancias líquidas: determinación de densidad, punto de ebullición, índice de refracción; para sólidos: determinación del punto de fusión y varios otros; los segundos métodos incluyen análisis químicos, cualitativos y cuantitativos, para el contenido de impurezas.
No hay sustancias absolutamente puras. Las sustancias utilizadas en la práctica de laboratorio tienen diferentes grados de pureza. La cantidad máxima permitida de impurezas en una sustancia está establecida por All-Union Standard (GOST).
Las sustancias marcadas como químicamente puras son adecuadas para trabajos de laboratorio sobre química inorgánica y análisis cualitativo. (contiene 10 -5 - 10-7% impurezas) y h.d.a. (contiene alrededor de 10-4 % impurezas).
La nueva técnica requería el uso de sustancias de especial pureza -ultrapuras o extrapuras- con un contenido de impurezas del orden de 10 -5 - 10-7% Para obtenerlos, se utilizan métodos especiales de purificación. Así, para la purificación profunda de materiales semiconductores, se utiliza ampliamente el método de fusión por zonas, basado en la distribución desigual de impurezas entre las fases líquida y sólida debido a su desigual solubilidad. Este método permite obtener germanio con un contenido del elemento principal de al menos 99,99999%.
Los métodos para obtener sustancias altamente puras se discuten en la literatura especial.
3. Métodos especiales de purificación
3.1 Diálisis
Diálisis se puede utilizar para separar y purificar sustancias disueltas en agua o en un disolvente orgánico. Esta técnica se usa con mayor frecuencia para purificar sustancias de alto peso molecular disueltas en agua a partir de impurezas de bajo peso molecular o de sales inorgánicas. (2)
Para la limpieza por diálisis son necesarios los llamados tabiques o membranas semipermeables, cuya peculiaridad radica en que tienen poros que permiten el paso de sustancias cuyas moléculas o iones son más pequeños que los poros y retienen sustancias cuyas moléculas o los iones son más grandes que los poros. los poros de la membrana. Así, la diálisis puede considerarse como un caso especial de filtración.
Arroz. 4. Dializador con agitador.
Como tabiques o membranas semipermeables, se pueden usar películas de muchas sustancias de alto peso molecular y alto polímero. Como membranas se utilizan películas de gelatina, albúmina, pergamino, películas de celulosa hidratada (como el celofán), películas de éteres de celulosa (acetato, pygrate, etc.) y muchos productos de polimerización y condensación. De las sustancias inorgánicas, se utilizan las siguientes: porcelana no esmaltada, baldosas de algunas variedades de arcilla cocida (como las arcillas coloidales, como la bentonita), vidrio prensado finamente poroso, cerámica, etc.
Los principales requisitos de las membranas son: 1) insolubilidad en el disolvente sobre el que se prepara la solución dializable; 2) inercia química con respecto tanto al solvente como a los solutos; 3) suficiente resistencia mecánica.
Muchas membranas pueden hincharse en agua u otro solvente, perdiendo su resistencia mecánica. La película hinchada puede dañarse o destruirse fácilmente. En estos casos, la película de diálisis se fabrica sobre alguna base sólida, por ejemplo, sobre un tejido inerte al disolvente (algodón, seda, fibra de vidrio, fibra sintética, etc.), o sobre papel de filtro. En ocasiones, para dar resistencia mecánica a las membranas, se refuerzan con mallas metálicas (refuerzo) del metal correspondiente (bronce, platino, plata, etc.).
Para obtener diferentes porosidades para membranas a base de éteres de celulosa o de alguna otra sustancia altamente polimérica, se introducen diferentes cantidades de agua en los barnices correspondientes. Cuando la película de laca se seca, se obtiene una membrana de color lechoso, que tiene una porosidad determinada (para más información, consulte el Capítulo 9 "Filtración").
Para la diálisis se utilizan aparatos llamados dializadores (fig. 4). Pueden tener diferentes diseños. La técnica de trabajar con dializadores es muy sencilla. Una membrana semipermeable suele dividir el dispositivo en dos partes. Una mitad del aparato se llena con la solución a dializar y la otra mitad con disolvente puro, siendo este último habitualmente renovado (flujo constante de líquido). Si el solvente puro no se cambia, entonces las concentraciones de sustancias que pasan a través de la membrana en ambos lados eventualmente se equilibrarán y la diálisis prácticamente se detendrá. Si el solvente se actualiza constantemente, a partir de la solución dializable es posible eliminar prácticamente todas las sustancias solubles que pueden penetrar en la membrana.
La tasa de diálisis no es la misma para diferentes sustancias y depende de una serie de condiciones y propiedades de la sustancia que se purifica. El aumento de la temperatura de la solución y la actualización del solvente contribuyen a la aceleración de la diálisis.
En muchos casos, se utiliza la electrodiálisis en lugar de la diálisis convencional. El uso de corriente eléctrica en la diálisis acelera el proceso y proporciona otros beneficios.
Precipitación de sustancias poco solubles. Esta técnica es muy utilizada con fines analíticos, obteniendo sedimentos que contienen una sola sustancia, inorgánica u orgánica. El precipitado resultante se puede purificar aún más bien por lavado ("Filtración", o por reprecipitación después de que el precipitado se haya disuelto, o por extracción con disolventes apropiados en condiciones específicas para cada caso.
El aparato utilizado para llevar a cabo este método depende de las propiedades de las sustancias y de las propiedades de los disolventes. A menudo, la operación se puede realizar simplemente en un vaso o en un matraz. En otros casos se ensamblan equipos estancos, similar al descrito en el Cap. 10 "Disolución". Los precipitados se filtran, se lavan y luego se someten a un procesamiento posterior (recristalización, secado, etc.).
La separación del precipitado maloliente de las aguas madres se puede lograr mediante la decantación seguida del lavado del precipitado mediante decantación o centrifugación. Cuanto más larga es la sedimentación, más compacta es la capa de sedimentos. Sin embargo, no se recomienda dejar reposar los precipitados por mucho tiempo, ya que con el tiempo pueden ocurrir procesos secundarios (adsorción de otros iones, complejación con el solvente) entre el precipitado y las aguas madres, que dificultan el posterior "tratamiento de el precipitado separado.
3.2 Complejización
complejación es una de métodos para aislar sustancias puras, especialmente inorgánicas. Los compuestos complejos pueden ser escasamente solubles en agua, pero fácilmente solubles en solventes orgánicos, o viceversa. En el primer caso, la precipitación se trata como se describe anteriormente. Si el compuesto complejo es fácilmente soluble en agua, se puede recuperar en forma pura a partir de una solución acuosa mediante extracción con un disolvente orgánico adecuado, o se puede destruir el complejo de una forma u otra. (3)
El método de complejación puede aislar metales en una forma muy pura. Esto es especialmente cierto para metales raros y trazas, que pueden aislarse en forma de complejos con sustancias orgánicas.
Formación de compuestos volátiles. Esta técnica se puede utilizar si se forma un compuesto volátil solo a partir de la sustancia emitida, por ejemplo, un metal. En el caso de que se formen simultáneamente compuestos volátiles de impurezas, no se recomienda esta técnica, ya que la liberación de las impurezas volátiles puede resultar difícil. En muchos casos, la formación de haluros volátiles (cloruros o fluoruros) de ciertas sustancias puede ser muy eficaz como método de purificación, especialmente en combinación con la destilación al vacío. Cuanto menor sea el punto de sublimación o ebullición de la sustancia que nos interesa, más fácil será separarla de otras y purificarla por destilación fraccionada o difusión.
La velocidad de difusión de las sustancias gaseosas a través de los tabiques semipermeables depende de la densidad y del peso molecular de la sustancia a depurar y es casi inversamente proporcional a ellos,
3.3 Zona de fusión
La fusión por zonas se puede considerar como un caso especial de extracción con una sustancia fundida, cuando la fase sólida de la sustancia está en equilibrio con su fase líquida. Si la solubilidad en la fase líquida de cualquier impureza contenida en la sustancia a purificar difiere de la solubilidad en la fase sólida, entonces la purificación a partir de esta impureza es teóricamente posible*. Este método es especialmente valioso para la purificación de tales compuestos (predominantemente orgánicos) que tienen una baja presión de vapor o se descomponen durante la destilación. (4) Para compuestos que tienen baja conductividad térmica, se puede crear una zona de fusión aplicando calentamiento de alta frecuencia con resistencia dieléctrica. El método de fusión por zonas permite utilizar completamente las sustancias iniciales y permite obtener monocristales grandes de sustancias orgánicas y algunos metales (por ejemplo, aluminio, germanio, etc.).
En su forma más simple, la fusión por zonas aplicada a los metales consiste en mover lentamente una zona fundida a lo largo de una barra de metal.
El método de fusión por zonas se puede utilizar ampliamente para la preparación de compuestos orgánicos puros. (5)
Actualmente se están realizando esfuerzos para aplicar el método de fusión por zonas para purificar líquidos. Este método resultó ser aplicable para "la limpieza solo de líquido precongelado". dispositivo de enfriamiento circulante que funciona con una mezcla de dióxido de carbono sólido con acetona. El líquido congelado en el bote se arrastra lentamente usando un motor Warren a una velocidad de 1 cm / h a través de varios calentadores de zona sucesivos ubicados a una distancia de aproximadamente 1,8 cm de cada uno otro y que representa bobinas de alambre de nicromo con un diámetro de 0,5 mm ( 0,5 ohm / m) en las ranuras de pequeños bloques de cerámica.La intensidad actual se selecciona de modo que la temperatura de las zonas estrechas fundidas en el líquido congelado sea 3--4 °C. Las zonas fundidas, moviéndose una tras otra, arrastran las impurezas que había en el líquido. Las impurezas se concentran en la parte final de la barra de líquido congelado. Esta técnica se puede utilizar para purificar soluciones acuosas y no acuosas y aislar disuelto o t Solo sustancias finamente dispersas. (6)
La instrumentación del método de fusión por zonas depende de las propiedades de las sustancias tomadas, y es difícil recomendar cualquier aparato estándar en este caso. (7)
3.4 Cromatografía
Método de cromatografía es especialmente importante para concentrar sustancias cuyo contenido en la solución inicial es muy pequeño, así como para obtener preparados puros. Mediante este método se obtuvieron elementos de tierras raras y saurap de alta pureza. Muchas preparaciones farmacéuticas y orgánicas se purifican y obtienen en forma pura utilizando este método. En casi todos los casos, cuando la tarea es purificar o separar una sustancia de una mezcla en solución, la cromatografía y el intercambio iónico pueden ser métodos fiables.
Para el intercambio iónico se utilizan los denominados intercambiadores iónicos, que son adsorbentes inorgánicos u orgánicos (principalmente resinas de diferentes marcas). Según sus propiedades químicas, se dividen en los siguientes grupos: catonitas, anionitas y anfolitas. Los intercambiadores de cationes intercambian cationes. Los intercambiadores de aniones tienen la capacidad de intercambiar aniones. Los anfoigtos son capaces de intercambiar tanto cationes como aniones, dependiendo del pH del medio y de las propiedades de la sustancia a ser absorbida por el intercambiador de iones. (ocho)
Los intercambiadores de iones son capaces de intercambiar iones hasta que están completamente saturados con el ion absorbido. Los intercambiadores de iones gastados se regeneran lavando los intercambiadores de cationes con ácido, los intercambiadores de aniones con álcalis.* El eluato (líquido obtenido al lavar el intercambiador de iones) contendrá iones adsorbidos por el intercambiador de iones.
Para la separación y fraccionamiento de polímeros se propuso un método de filtrado de sus soluciones a través de un gel denominado “Sephadex” (Suecia). Este método se llama gel - f y l t r a c y e y. Esencialmente, es la separación cromatográfica de sustancias macromoleculares en una columna.
Sephadex se produce en forma de pequeños granos que se hinchan en agua. (9)
Al usar otras sustancias, los límites de pesos moleculares pueden desviarse de los valores dados en una dirección u otra. Así, para las proteínas, los rangos de pesos moleculares son más amplios que para los polisacáridos. Se construyó una columna cromatográfica encamisada para usar Sephadex; La columna está hecha de vidrio de borosilicato. (diez)
Primero, Sephadex se mezcla con agua, la mezcla resultante se agita, se vierte en una columna y se deja sedimentar. Luego, se agrega una solución concentrada de la sustancia de prueba a la columna para que la capa superior de Sephadex no se turbe. El equilibrio se establece muy rápidamente, por lo que la tasa de lavado puede ser alta en comparación con los iopites ordinarios. Las fracciones se controlan ya sea espectrofotométricamente (polímeros orgánicos) o por conductividad eléctrica (soluciones de sustancias inorgánicas). El método de filtración en gel reemplaza completamente la diálisis y la electrodiálisis. Con su ayuda, es posible fraccionar muy finamente polímeros que difieren poco entre sí en pesos moleculares.
4. Parte experimental
Purificación de sulfato de cobre por recristalización
Usando la tabla de solubilidad del sulfato de cobre (Apéndice No. 1), calcule cuánta agua y sulfato de cobre se debe tomar para preparar tal cantidad saturada a 80 º Con una solución salina, a partir de la cual, al enfriarse posteriormente a 0 º C liberaría 10 g de CuSO4 5H 2Vaya
El sulfato de cobre está contaminado con una pequeña cantidad de cloruro de potasio, así como con impurezas insolubles (arena, trozos de carbón). Por lo tanto, debe tomarse un 10% más de lo calculado.
Medir el volumen calculado de agua destilada con una probeta, verterlo en un microvaso de 50 ml, calentar hasta que comience a hervir y disolver una muestra de sulfato de cobre mientras se agita con una varilla de vidrio.
Asegúrese de que la solución preparada contenga iones de cloruro. Para ello, vierta 3 gotas de la solución en un tubo de ensayo cónico, agregue 1 gota de la solución de AgNO 3y 2 gotas de ácido nítrico. Cae un precipitado blanco.
Después de la prueba de iones de cloruro, la solución de sulfato de cobre calentada hasta el punto de ebullición se filtra a través del embudo de filtración caliente que se muestra en la Fig. 4 (separación de impurezas insolubles). Una solución saturada durante dicha filtración no se enfriará, lo que significa que la sustancia no cristalizará en el filtro y, por lo tanto, complicará el proceso de filtración. El embudo se calienta encendiendo la corriente eléctrica.
Para acelerar la filtración, se recomienda utilizar un filtro plisado, que debe prepararse previamente. El método de fabricación de filtros lisos (simples) es visible en la fig. 5. Un filtro doblado (Fig. 6) se hace de la siguiente manera: primero, se hace un filtro grande y liso, luego se dobla por la mitad y cada mitad se dobla varias veces en una dirección y en la otra, como una armónica. El filtro no debe alcanzar los bordes del embudo de 5 a 10 mm.
Mientras agita el filtrado con una varilla de vidrio, enfríelo primero a temperatura ambiente y luego a 0 º C (en un cristalizador con agua y hielo).
Separar los cristales de sal precipitados de las aguas madres por filtración. La filtración se realiza mejor a presión reducida en un embudo Buchner. Esto acelera enormemente el proceso de filtrado. Se inserta un embudo Buechner con un tapón de goma en un matraz Bünsen (matraz de pared gruesa con un proceso). Se coloca un círculo de papel de filtro en la placa del embudo con poros, que humedezco con agua para que se ajuste mejor a la placa, se llena el embudo con una solución filtrada y el proceso lateral se conecta a una bomba de agua. La filtración usando un embudo Buchner se muestra en la fig. 7.
Retire los cristales de sal del embudo y exprímalos entre hojas de papel de filtro hasta que ya no se peguen a la varilla de vidrio seca. Pesar la sal resultante en una balanza tecnoquímica. Determine el rendimiento porcentual de sal, tomando la cantidad calculada de CuSO 45H 2O, que en teoría debería haber destacado, al 100%.
Pruebe la solución de sal purificada y las aguas madres para detectar la presencia de iones de cloruro.
4.1 Ejemplo de solución de un problema
¿Cuántos gramos de agua y sulfato de cobre se deben tomar para preparar tal cantidad saturada a 80 º De una solución que, cuando se enfría a 0 º Con asignar 5 g de sulfato de cobre?
Solución: De la tabla de solubilidad (Apéndice 1) encontramos que se deben tomar x g de CuSO en 100 g de una solución saturada 45H 2O. Si en 0 º Dado que caen 5 g de sulfato de cobre, entonces (x-5) g permanecerán en la solución. En términos de sal anhidra, esto será (x - 5): o d) Calcular la cantidad de solución que contiene
gramo sal:
12,9 g de sal anhidra están contenidos en 100 g de solución
a = g.
Cuando se calienta a 80? Con obtenemos una solución saturada, en la cantidad
Contendrá sulfato de cobre.
Este número es x. Después
Por lo tanto, x = 25,3 g.
¿A los 80? Con la cantidad calculada de sal se saturará
g solución
Se debe tomar agua
46,5 g - 25,3 g = 21,2 g o 21,2 ml.
Para resolver este problema de otra forma, haciendo un cálculo preliminar de la cantidad de sal por la misma cantidad de agua.
9 g CuSO 4corresponden a 34,9 × 1,56 = 54,44 g CuSO 4?5H 2O y 12,9 g CuSO 4 - 20.12CuSO 4?5H 2O. En solución saturada:
¿A los 80? C para 54,44 g CuSO 4?5H 2O representa 45,56 g H2 O
С20.12 Cu SO 4?5H2 079.88H 2O
СXCuSO 4?5H2 045.56H 2O
Cuando la solución se enfría de 80 a 0? Con obtenemos:
44 - 11.47 \u003d 42.97 g de sulfato de cobre.
La cantidad de agua y sal se obtiene de la relación:
97 g CuSO 4?5H 2O - 45,56 g H 2O
5 Cu SO 4?5H2 O-yH 2O
42,97 g CuSO 4?5H 2O precipita de 54,44 g de CuSO4 ?5H 2O
5 Cu SO 4?5H 2OzCuSO4 ?5H 2O
Podría ser así:
rCuSO 4?5H 2o partidos Cu SO 4. Dejar en 80? Con es necesario tomar x g CuSO 4 solución vyg. Después
A 0°C después de la precipitación de 5 g CuSO 4?5H 2O o 12,82 CuSO 4el peso x disminuirá en 12,82 g (x - 12,82) g CuSO permanecerá 4en (y - 20) g de solución. Medio
Pero x=0.349y.
Después Donde y=46.54 g de solución. X \u003d 0,349 \u003d 46,54 g \u003d 16,24 g CuSO 4o 25,3 g CuSO 4?5H 2O. Se debe tomar agua: 46,54 g - 25,33 g = 21,2 g o 21,2 ml.
Conclusión
En este trabajo de curso se consideraron algunos de los métodos más utilizados para la purificación de sustancias en química (recristalización, sublimación, destilación, etc.).
Estos métodos son bastante efectivos y, a menudo, aplicables, su ventaja radica en el bajo costo del equipo necesario para el trabajo y la velocidad de limpieza, pero todos tienen un inconveniente, ninguno de los métodos propuestos se puede utilizar para obtener una sustancia ultrapura. .
Nuestra ciencia no se detiene y existen nuevos métodos de purificación de sustancias utilizando equipos más complejos y precisos. En este trabajo se consideraron la cromatografía, la diálisis, la formación de complejos, etc.. Con estos métodos podemos obtener una sustancia ultrapura. Pero siguen siendo caros y ninguno de ellos es universal.
El tema de la purificación de sustancias seguirá siendo relevante, ya que constantemente se desarrollarán nuevos métodos para la obtención de sustancias ultrapuras, que son cada vez más demandadas en la industria y los experimentos científicos.
Lista de fuentes y literatura utilizadas
1. Pfain V. J. Zone melting / V. J. Pfain - M .: Metallurgizdat, 1960. - 384 p.
2. Herington E. Zoya fundición de sustancias orgánicas / E. Herington; por. De inglés. - M.: Mir, 1965. - 547 p.
Abakumov B. I. Instalación para zona de fusión / B. I. Abakumov, E. E. Konovalov. - M. : RZhKhim, 1964, 367 p.
Shplkin AI Instalación para fusión por zonas sin crisol de sustancias con baja tensión superficial / IA Shplkin, AA Kiliev. - M. : RZhKhim, 1964. - 230 p.
Musso H. Sobre nuevos métodos de separación en química / N. Musso; por. De inglés. -METRO. : RZhKhim, 1958. - 654 p.
Linstead R. Sobre métodos cromatográficos de purificación y aislamiento de sustancias / R. Linstead; por. De inglés. - M. : Izdatinlit, 1959. - 476 p.
Gorshkov V. I. / I. V. Gorshkov, V. A. Fedorov, A. M. Tolmachev. - M. : RZhKhim, 1966. - 187 p.
Niysel V. Sobre el método de separación de sustancias disueltas basado en la diferencia de velocidades de difusión / V. Niysel; por. De inglés. - M. : RZHKhim, 1964. - 479 p.
Shield-Knetch N. Separación de sustancias cristalizantes / N. Shield-Knetch; por. De inglés. - M. : RZHKhim, 1964. - 169 p.
Maley L. Aplicación de la cromatografía basada en la penetración de una sustancia en un gel a sustancias de bajo y alto peso molecular / L. Maley; por. De inglés. - M. : RZHKhim, 1965. - 540 p.